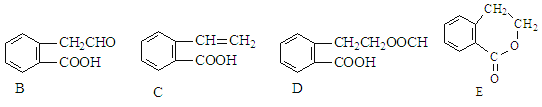
题目内容
【题目】一定条件下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_____________;x为_______________。
(2)若反应经2min达到平衡,平衡时C的浓度_______0.8mol/L(填“大于,小于或等于”)。
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0。请用P0、P来表示达平衡时反应物A的转化率α(A)为_______________%。
(4)能够说明该反应达到平衡的标志是_____________。
A.容器内混合气体的密度保持不变B.υ(A)=3υ(B)
C.A、B的浓度之比为3:1 D.单位时间内消耗3n molA的同时生成n molB
E.体系的温度不再变化
【答案】0.2mol/(Lmin) 2 小于 ![]() DE
DE
【解析】
(1)利用转化物质的量之比等于化学计量数之比计算变化的B的量,结合υ(B)=![]() 计算,利用转化物质的量之比等于化学计量数之比根据x的值;
计算,利用转化物质的量之比等于化学计量数之比根据x的值;
(2)根据随着反应的进行反应物的浓度减少,反应速率减慢,据此判断;
(3)相同条件下,压强之比等于物质的量之比,据此计算平衡后混合气体总的物质的量,利用差量法计算参加反应的A的物质的量,再根据转化率定义计算。
(4)根据平衡状态时物质的浓度不变、物质的含量不变及同一物质表示的正、逆反应速率相等判断平衡状态。
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,由于反应开始时A的物质的量是3mol,则参加反应的A的物质的量△n(A)=3mol-1.8mol=1.2mol,由于参加反应的物质的量之比等于化学计量数之比,则参加反应的B的物质的量△n(B)=1.2mol×![]() =0.4mol,υ(B)=
=0.4mol,υ(B)=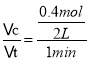 =0.2mol/(Lmin),生成的C的物质的量n(C)=0.4mol/L×2L=0.8mol,由方程式可知,A、C变化的物质的量的比=1.2mol:0.8mol=3:x,解得x=2;
=0.2mol/(Lmin),生成的C的物质的量n(C)=0.4mol/L×2L=0.8mol,由方程式可知,A、C变化的物质的量的比=1.2mol:0.8mol=3:x,解得x=2;
(2)随着反应的进行,物质的浓度逐渐降低,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0,则平衡后混合气体总的物质的量n(平衡)=(3mol+1mol)×![]() mol,故平衡后混合气体物质的量减少量为(4-
mol,故平衡后混合气体物质的量减少量为(4-![]() )mol,则根据反应方程式:
)mol,则根据反应方程式:
3A(g)+B(g)![]() 2C(g) 物质的量减少△n
2C(g) 物质的量减少△n
3 2
n(A) (4-![]() )mol
)mol
故n(A)= (4-![]() )mol×
)mol×![]() = (6-
= (6-![]() )mol,所以A物质的转化率为
)mol,所以A物质的转化率为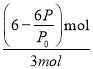 ×100%=
×100%=![]() %。
%。
(4) A.由于反应混合物都是气体,容器的容积不变,因此任何条件下气体的密度都不变,故不能根据容器内混合气体的密度保持不变判断平衡状态,A错误;
B.在任何条件下用A、B表示的反应速率都符合关系υ(A)=3υ(B) ,所以不能确定反应是否达到平衡状态,B错误;
C.A、B两种物质加入的物质的量的比是3:1,消耗的物质的量的比是3:1,因此无论反应是否达到平衡状态,A、B的浓度之比总为3:1,不能据此判断是否为平衡状态,C错误;
D.单位时间内消耗3n molA,就会消耗nmolB,同时生成n molB,说明B的浓度不变,反应达到平衡状态,D正确;
E.任何反应过程中都有化学键的断裂和形成,因此都会有能量发生变化,若体系的温度不再变化,说明反应达到平衡状态,E正确;
故合理选项是DE。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | C2H5OH(H2O) | Na | 蒸馏 |
B | CH4(C2H4) | 溴水 | 洗气 |
C | 苯(苯酚) | 浓溴水 | 过滤 |
D | 甲苯(苯) | 酸性高锰酸钾溶液 | 分液 |
A.AB.BC.CD.D
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D