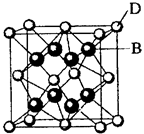
题目内容
(12分)
(1)五种元素的原子电子层结构如下:A:1s22s22p63s2 B:1s22s22p63s23p63d54s2 C:1s22s1 D:1s22s22p63s23p2 E:1s22s22p6。请回答:(填元素符号)
元素的电负性最大, 元素原子的第一电离能最小, 元素最可能生成具有催化性质的氧化物。
(2)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”, 钛有4822Ti和5022Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 ,按电子排布Ti元素在元素周期表分区中属于 区元素。
(3)A、B两种元素的电离能数据如下(kJ·mol—1):
|
电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
577 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
化合价是元素的一种性质。由A、B的电离能数据判断,A通常显 价,B显 价。
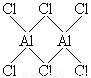
(4)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示。请将图中你认为是配位键的斜线上加上箭头。
(5)假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充。当有25%的硅原子被铝原子取代时,可形成正长石。则正长石的化学组成为 。
(6)CO2与SiO2比较沸点相差很大的原因是 。
(1)Si Li Mn(元素符号)
(2)同位素;第四周期第IVB族; d区 (3)+3 +2
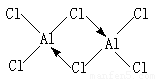
(4)
(5)KAlSi3O8 (6)CO2是分子晶体,SiO2是原子晶体
【解析】原子电子层结构可知,A是Mg,B是Mn,C是Li,D是Si,E是Ne。
(1)非金属性越强,电负性越大,所以是Si的电负性最大;Li的金属性最强,第一电离能最小;二氧化锰具有催化作用,所以是Mn元素。
(2)4822Ti和5022Ti两种原子,具有相同的质子数,不同的中子数,二者互为同位素;根据钛的质子数可知,钛位于第四周期第IVB族;区的名称来自于按照构造原理最后填入电子能级的轨道名称,所以钛元素属于d区。
(3)A的第四电离能远大于第三电离能,所以A是第ⅢA元素,显+3价;B的第三电离能远大于第二电离能,即B是第ⅡA元素,显+2价。
(4)在气态氯化铝中,氯原子是配体,提供孤对电子,铝原子提供空轨道,所以结构为 。
。
(5)根据价电子可知,1个硅被1个铝原子取代的同时,还需要1个钾原子,所以K、Al、Si、O的硅酸的个数之比是0.25︰0.25︰0.75︰2=1︰1︰3︰8,即化学式为KAlSi3O8。
(6)由于CO2是分子晶体,SiO2是原子晶体,所以CO2的熔沸点远低于二氧化硅的。

下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
|
元素 |
相关信息 |
|
W |
单质为密度最小的气体 |
|
X |
元素最高正价与最低负价之和为0 |
|
Y |
工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
|
Z |
存在质量数为23,中子数为12的核素 |
|
T |
金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
根据上述信息填空:
(1)元素Y在元素周期表中的位置是 。XY2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素Y和Z组成,写出甲的化学式: ,
(3)化合物乙由元素W和X组成,乙是同时含极性共价键和非极性共价键的相对分子质量最小的分子。在25℃、101kpa下,已知2g的气体乙在Y2气体中完全燃烧后恢复至原状态,放热QkJ,该燃烧反应的热化学方程式是 。
(4)化合物丙仅由W、X、Y、Z、T中的四种元素组成,四种元素的质量比为1:6:40:64,化合物丙中含有两种阴离子,写出燃烧丙的化学方程式 。
部分中学化学常见元素原子结构及性质如表所示
|
序 号 |
元素 |
结构及性质 |
|
① |
A |
A在第三周期中简单离子半径最小 |
|
② |
B |
B原子最外层电子数是内层电子数的1/5 |
|
③ |
C |
C是常用化肥的主要元素,单质常温下呈气态 |
|
④ |
D |
通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
|
⑤ |
E |
E在周期表中可以排在IA族,也可以排在ⅦA族 |
(1)A原子中的电子占有______个轨道,最外层有______种不同运动状态的电子。这五种元素的原子半径由大到小的顺序为_________________(用元素符号表示)。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。