题目内容
某温度时水的离子积常数为1.0×10-14,由此可知在该温度时水的电离度为( )
分析:纯水中,氢离子浓度等于氢氧根离子浓度,电离的水分子物质的量与未电离前水分子物质的量的比即是水的电离度.
解答:解:纯水中,氢离子浓度等于氢氧根离子浓度,某温度时水的离子积常数为1.0×10-14,
则c(H+)=c(OH-)=1.0×10-7mol/L,
1L水的物质的量=
=55.56mol,
则其电离度=
×100%=1.8×10-7%,
故选A.
则c(H+)=c(OH-)=1.0×10-7mol/L,
1L水的物质的量=
| 1000g |
| 18g/mol |
则其电离度=
| ||
| 18g/mol |
故选A.
点评:本题考查了弱电解质的电离,注意1L水物质的量的计算,为易错点.

练习册系列答案
相关题目
| |||||||||||||||||||||||||||
(16分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-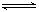 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 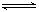 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________,原因是 。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_______,通过计算确定上述方案______(填“可行”或“不可行”)。
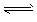 H++A2-,试回答下列问题:
H++A2-,试回答下列问题: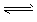 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。