题目内容
如图所示为海水综合利用部分流程,有关说法错误的是( )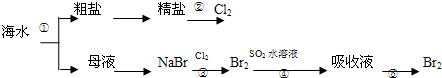

| A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 | B、②是一个将电能转化为化学能的过程 | C、③④⑤涉及的反应均为氧化还原反应 | D、④中反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br- |
分析:A.根据进行①的操作为蒸发确定仪器;
B.根据电解过程中是电能转化为化学能;
C.根据氧化还原反应中元素的化合价发生变化;
D.根据反应④是二氧化硫被单质溴氧化生成硫酸和氢溴酸;
B.根据电解过程中是电能转化为化学能;
C.根据氧化还原反应中元素的化合价发生变化;
D.根据反应④是二氧化硫被单质溴氧化生成硫酸和氢溴酸;
解答:解:A.蒸发需用到蒸发皿、玻璃棒、酒精灯、铁架台等,故A错误;
B.由“母液→无水MgCl2”一系列变化中元素的化合价发生变化,未涉及氧化还原反应,故B正确;
C.③⑤发生离子方程式为:2Br-+Cl2═Br2+2Cl-,④发生的离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-,元素化合价都发生变化,属于氧化还原反应,故C正确;
D.反应④是二氧化硫被单质溴氧化生成硫酸和氢溴酸,离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-,故D正确;
故选A.
B.由“母液→无水MgCl2”一系列变化中元素的化合价发生变化,未涉及氧化还原反应,故B正确;
C.③⑤发生离子方程式为:2Br-+Cl2═Br2+2Cl-,④发生的离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-,元素化合价都发生变化,属于氧化还原反应,故C正确;
D.反应④是二氧化硫被单质溴氧化生成硫酸和氢溴酸,离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-,故D正确;
故选A.
点评:本题主要考查了粗盐的提纯和物质的制备,涉及蒸发操作仪器、氧化还原反应判断、离子方程式书写等,注意基础知识的掌握.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
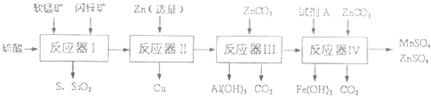
科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O
(2)反应器II中发生反应的离子方程式为______.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______.
(4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______.
科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
请回答:
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O
(2)反应器II中发生反应的离子方程式为______.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______.
(4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______.

已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+______+H2SO4→______+______+CuSO4+H2O
(2)反应器II中发生反应的离子方程式为______.
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因______.检验ZnCO3是否过量的操作方法是______.
(4)反应器中IV中,试剂A可以是下列物质中______(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为______,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是______.