题目内容
【题目】化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空。
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是_____,_________,________,______。

实验编号 | ①中的物质 | ②中的物质 |
1 | 淀粉碘化钾溶液 | 浓硝酸 |
2 | 酚酞溶液 | 浓硫酸 |
3 | 氯化铝溶液 | 浓氨水 |
4 | 湿润的红纸 | 饱和氯水 |
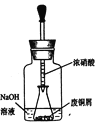
(2)用下图装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。
(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题。
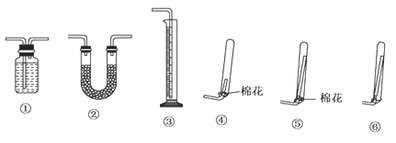
①若要测定生成的NH3的体积,则必须选择的装置是______(填装置序号),装置中所盛试剂应具有的性质是_______,收集干燥的NH3,收集装置应选择(填装置序号)_______,理由是__________。
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1—10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式_______。
(4)下图是苯与溴发生反应并进行产物检验的反应装置:

实验装置中的冷凝管“左低右高”的放置目的是____________,整套实验装置中能防止倒吸的装置是_____(填装置序号)。
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫。
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)________。
(6)如果要验证③是否成立的实验方法是______________________。
【答案】变蓝 无明显现象 有白色(胶状)沉淀 变白 NaNO3、NaNO2 ① ③ 氨气难溶于该溶剂,该溶剂不易挥发、不与氨气反应 ⑤ 导管较长,棉花可以防止空气对流,有利于收集到较为干燥纯净的氨气 Ca2++2NH3+CO2+H2O=CaCO3+NH4+ 使冷凝回流的反应物苯和液溴回到(Ⅰ)中继续反应 (Ⅱ)(Ⅲ) 2H2S+SO2=2H2O+3S↓ 取少量未知液于试管中,先滴加过量的稀盐酸,无任何现象(无沉淀生成、无气体出现),再滴加氯化钡溶液,出现白色沉淀
【解析】
(1)1、浓硝酸易挥发进入淀粉碘化钾溶液氧化碘离子为碘单质,碘单质遇碘变蓝;
2、浓硫酸具有吸水性,酚酞溶液无颜色变化;
3、浓氨水易挥发进入氯化铝溶液中生成氢氧化铝沉淀;
4、饱和氯水中会挥发出氯气,氯气遇到湿润的红纸会生成次氯酸漂白红纸为白色;
(2)铜和浓硝酸反应生成二氧化氮气体,二氧化氮气体和氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水;
(3)①依据装置图分析气体体积需要用排水量气方法测量;所排的液体不许是不和氨气反应,不能溶解氨气,不挥发;
②氨比空气轻,易溶于水,需要用向下排气法收集导气管应深入试管底部;
③向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1-10nm之间)碳酸钙是胶体;
(4)冷凝管“左低右高”是为了使挥发的苯和溴蒸气回流,反应物充分利用;依据装置分析防倒吸的是Ⅱ、Ⅲ;
(5)研钵中的样品露置在空气中两天,会被氧化为从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡为硫化氢和二氧化硫,充分振荡二氧化硫和硫化氢气体反应生成单质硫;
(6)依据检验硫酸根离子的实验方法设计。
(1)1、浓硝酸易挥发进入淀粉碘化钾溶液氧化碘离子为碘单质,碘单质遇碘变蓝;
2、浓硫酸具有吸水性,酚酞溶液无颜色变化;
3、浓氨水易挥发进入氯化铝溶液中生成氢氧化铝沉淀;
4、饱和氯水中会挥发出氯气,氯气遇到湿润的红纸会生成次氯酸漂白红纸为白色;
故答案为:变蓝、无明显现象、有白色胶状沉淀、变白;
(2)铜和浓硝酸反应生成二氧化氮气体,二氧化氮气体和氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,所以溶液中除了氢氧化钠外,还有NaNO3、NaNO2,故答案为:NaNO3、NaNO2;
(3)①依据装置图分析气体体积需要用排水量气方法测量,需要选择①③;所排的液体必须是不和氨气反应,不能溶解氨气,不挥发;氨比空气轻,易溶于水,需要用向下排气法收集导气管应深入试管底部,需要选择装置⑤,棉花可以防止空气对流,有利于收集到较为干燥纯净的氨气,故答案为:①③,氨气难溶于该溶剂,该溶剂不易挥发、不与氨气反应;⑤;导管较长,棉花可以防止空气对流,有利于收集到较为干燥纯净的氨气;
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级碳酸钙是胶体,依据原子守恒得到离子方程式为Ca2++2NH3+CO2+H2O=CaCO3+NH4+,故答案为:Ca2++2NH3+CO2+H2O=CaCO3+NH4+;
(4)由图可知苯与溴发生反应并进行产物检验的反应装置实验装置中的冷凝管“左低右高”是为了使挥发的苯和溴蒸气回流,反应物充分利用;依据装置分析防倒吸的是Ⅱ、Ⅲ,故答案为:使冷凝回流的反应物苯和液溴回到(Ⅰ)中继续反应;(Ⅱ)(Ⅲ);
(5)研钵中的样品露置在空气中两天,会被氧化为从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡为硫化氢和二氧化硫,充分振荡二氧化硫和硫化氢气体反应生成单质硫,故答案为:2H2S+SO2=2H2O+3S↓;
(6)假设③是固体硫化钠易被空气中的氧气氧化为硫酸钠,要验证③是否成立的实验方法是验证是否生成物中含硫酸根离子,检验方法为:取少量未知液于试管中,先滴加过量的稀盐酸,无任何现象,再滴加氯化钡溶液,出现白色沉淀,故答案为:取少量未知液于试管中,先滴加过量的稀盐酸,无任何现象(无沉淀生成、无气体出现),再滴加氯化钡溶液,出现白色沉淀。

【题目】已知:-CHO+(C6H5)3P=CH-R -CH=CH-R + (C6H5)3P=O,R代表原子或原子团,W是一种有机合成中间体,结构简式为:HOOC-CH=CH-CH=CH-COOH,其合成方法如下:
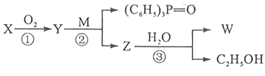
其中,![]() 分别代表一种有机物,合成过程中其他产物和反应条件已略去。
分别代表一种有机物,合成过程中其他产物和反应条件已略去。
X与W在一定条件下反应可以生成酯N,N的相对分子质量为168。
请回答下列问题:
(1)W能发生反应的类型有__________。(填写字母编号)
A.取代反应 | B.水解反应 | C.氧化反应 | D.加成反应 |
(2)写出X与 W在一定条件下反应生成N的化学方程式:___________________。
(3)写出含有3个碳原子且不含甲基的X的同系物的结构简式_________________
(4)写出第②步反应的化学方程式:____________________________________。