题目内容
 2NO2 (g)在下列过程中发生的变化描述正确的是( )
2NO2 (g)在下列过程中发生的变化描述正确的是( )
过程II:在平衡Ⅲ的基础上缩小体积,平衡向逆反应方向移动,a'>b',
对比过程Ⅰ与Ⅱ,平衡Ⅰ和Ⅲ相比较,平衡状态相同,转化率a'=a,b'=b.
B.在平衡I向平衡II过渡的过程中,再加入N2O4,相当于在原来的基础上缩小体积,平衡向逆反应方向移动,v(逆)>v(正),故B错误;
C.对比过程Ⅰ与Ⅲ,平衡Ⅱ和Ⅳ相比较,平衡状态相同,转化率a'=a,b'=b,故C错误;
D.平衡Ⅱ与平衡Ⅳ平衡状态相同,N2O4的质量分数相等,故D正确.
故选D.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案(1)已知25℃时几种物质(溶液浓度为0.1mol/L)的电离度如下表:(电离度:弱电解质已电离的分子的物质的量占分子总物质的量的百分数)(已知:H2SO4的第一步电离是完全的)
| ①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl |
| 10% | 29% | 1.33% | 100% |
i25℃时,0.1mol/L上述几种溶液c(H+)由大到小的顺序是(填序号) .
ii25℃时,将足量的Zn粉放入等体积、pH=1的上述几种溶液中,产生氢气的体积(同温同压下)由大到小的顺序是(填序号) .
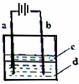 (2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
i a电极材料为 ,其电极反应式为 ;
电解过程中,b极附近溶液pH= (增大、减小、不变),
试用必要的文字说明原因 。
ii d电解液是 时,电解片刻后,装置中可见Fe(OH)2白色沉淀。
A.稀硫酸 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
iii 装置中液体c的作用是 。
以焦炭为原料的制氨流程示意如下:
I、“精制”过程是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨(化学式为[Cu (NH3)2]Ac)溶液,以获得纯净原料气。其中,吸收CO的反应为:
![]() CO+ [Cu (NH3)2]Ac+NH3·H2O [Cu (NH3)3CO]Ac +H2O
CO+ [Cu (NH3)2]Ac+NH3·H2O [Cu (NH3)3CO]Ac +H2O ![]() <0
<0
(1)为提高CO吸收率,可采取的一项措施是_________________________。
(2)除去氧气时,氧气将 [Cu (NH3)2]Ac氧化为 [Cu (NH3)4]Ac2,则反应中还原剂与氧化剂的物质的量之比是
II、“造气”过程中。其中,焦炭与水蒸气在反应体系中将发生如下四个反应:
![]() C(s)+2H2O(g) CO2(g)+2H2(g)
C(s)+2H2O(g) CO2(g)+2H2(g) ![]() 1=+90.2kJ·mol-1
1=+90.2kJ·mol-1
C(s)+H2O(g) CO(g)+ H2(g) ![]() 2=+131.4kJ·mol-1
2=+131.4kJ·mol-1
 CO(g)+ H2O(g) CO2(g)+ H2(g)
CO(g)+ H2O(g) CO2(g)+ H2(g) ![]() 3
3
C(s)+ 2H2(g) CH4(g) ![]() 4
4
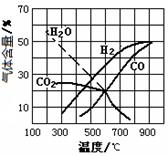
该体系中,一些物质的平衡组成与温度的关系图如右所示。
(3)由图可知,若采用焦炭与水蒸气反应来获得优质的水
煤气,工业生产中应尽量使焦炭和水蒸气在________(填“高
温”、“低温”或“常温”)条件下进行![]()
(4)![]() 3=__________________________。
3=__________________________。
(5)下表为碳与氢气合成甲烷的相关数据:
| 温度(℃) | 600 | 800 | 1000 |
| 平衡常数 | 3.2×100-146 | 1.0×10-2070 | 1.0×10-20000 |


