��Ŀ����
����Ŀ���ϳɰ���ҵ�ĺ��ķ�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)�ķ�Ӧ�����������仯��ͼ��ʾ���ش��������⣺
2NH3(g)�ķ�Ӧ�����������仯��ͼ��ʾ���ش��������⣺
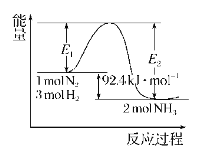
��1����H=______���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯��______����������������С������������������H (�������С�����䡱)��
��2����500����2��107 Pa�ʹ�����������һ�ܱ������г���0.5 mol N2��1.5 mol H2����ַ�Ӧ�ų�������_______(�<����>������)46.2 kJ������__________________________________��
��3����֪��25����101 kPaʱ��14��CO������ȫȼ�շų�����ΪQ kJ��
��д��COȼ���ȵ��Ȼ�ѧ����ʽ��______________________________________��
���𰸡���1��92.4 kJ/mol ��С ����
��2��< �÷�ӦΪ���淴Ӧ����Ӧ���ת����С��100�����Էų�������С��46.2 kJ
��3��CO(g)+1/2O2(g)![]() 1/2CO2(g) ��H=2Q kJ/mol
1/2CO2(g) ��H=2Q kJ/mol
�����������⿼���˻�ѧ��Ӧ�������ı仯����1���������仯��ͼ��֪��N2(g)+3H2(g)![]() 2NH3(g) ��H= E1 E2=92.4 kJ/mol��ʹ�ô����ı䷴Ӧ;�������ͻ�ܣ���E2��С���Ӵ�����ͬ�ȳ̶ȵĸı����淴Ӧ���ʣ�ƽ�ⲻ�ƶ���������H���䡣
2NH3(g) ��H= E1 E2=92.4 kJ/mol��ʹ�ô����ı䷴Ӧ;�������ͻ�ܣ���E2��С���Ӵ�����ͬ�ȳ̶ȵĸı����淴Ӧ���ʣ�ƽ�ⲻ�ƶ���������H���䡣
��2�����ڸ÷�ӦΪ���淴Ӧ����Ӧ���ת����С��100�������Էų�������С��46.2 kJ��
��3��14��CO������ȫȼ�շų�����Q kJ����1 mol CO������ȫȼ�շų�����Ϊ![]() Q kJ=2Q kJ����COȼ���ȵ��Ȼ�ѧ����ʽΪ��CO(g)+1/2O2(g)
Q kJ=2Q kJ����COȼ���ȵ��Ȼ�ѧ����ʽΪ��CO(g)+1/2O2(g)![]() 1/2CO2(g) ��H=2Q kJ/mol��
1/2CO2(g) ��H=2Q kJ/mol��

 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д�����Ŀ�������ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�������
���� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��1��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ��
��2������������ӦT1��ʱ��ƽ�ⳣ��K1=��
��3��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ��
��4����ͼΪ��T1��ﵽƽ�����t2��t3��t4��t5ʱ�ı�ijһ����Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯������������ı����������ͬ����֪t3��t4��Ϊʹ�ô��������жϸ÷�Ӧ��H0��������������� 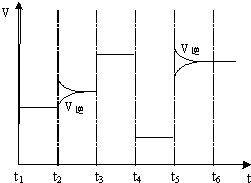
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
��1����ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ���� 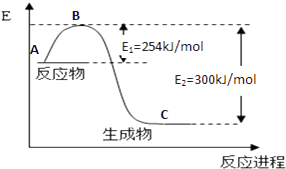
��2������֪�������ݣ�
��ѧ�� | H��H | N��N |
����/kJmol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���kJmol��1
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 �� E2�����������С���������䡱����
��4����NH3����ԭNOX���������������������Ⱦ������
4NH3��g��+3O2��g��=2N2��g��+6H2O��g������H1=akJ/mol
N2��g��+O2��g��=2NO��g������H2=bkJ/mol
��1mol NH3��ԭNO��N2 �� ��÷�Ӧ�����еķ�Ӧ�ȡ�H3=kJ/mol���ú�a��b��ʽ�ӱ�ʾ��