题目内容
将2 mol N2和6 mol H2置于装有催化剂的密闭容器中,当有25%的氮气转化为氨气时反应达到平衡。计算:(1)平衡时混合物中各组成成分的物质的量。
(2)平衡时气体的总物质的量。
(3)平衡时混合物中各组分的物质的量的百分含量、体积百分含量和质量百分含量。
(4)平衡混合气的平均相对分子质量。
(5)容器中反应前后的压强比(设温度不变)。
解析:
(1) N2 + 3H2 ![]() 2NH3
2NH3
起始/mol 2 6 0
转化/mol 2×25% 2×25%×3 2×25%×2
平衡时各物质的量:
N2:2 mol-2 mol×25%=1.5 mol
H2:6 mol-2 mol×25%×3=4.5 mol
NH3:2 mol×25%×2=1 mol
(2)平衡时气体的总体物质的量:1.5 mol+4.5 mol+1 mol=7 mol。
(3)平衡混合物中各组分的物质的量百分含量:
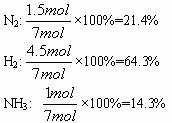
由于同温、同压下等物质的量的气体占有相同的体积,所以平衡混合物中N2、H2、NH3所占的体积分数也分别为21.6%、64.3%、14.3%。在平衡混合物中,各组分的质量分数分别为:
N2:![]()
H2:![]()
NH3:![]()
(4)混合气体的平均相对分子质量:![]() 。
。
(5)在温度和体积不变的情况下,气体的压强比等于它们的物质的量之比。所以容器中反应前与反应后的压强比为:![]() 。
。
答案:(1)N2:1.5 mol H2:4.5 mol NH3:1 mol
(2)7 mol
(3)体积及物质的量分数均是:N2:21.4% H2:64.3% NH3:14.3% 质量分数:N2:61.8% H2:13.2% NH3:25%
(4)9.7
(5)![]()

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目