��Ŀ����
����Ŀ���绯ѧԭ���ڷ�ֹ������ʴ������ת�������ʺϳɵȷ���Ӧ�ù㷺��
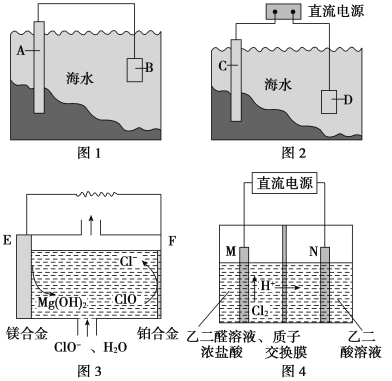
(1)ͼ1�У�Ϊ�˼�����ˮ�Ը�բ��A�ĸ�ʴ������B����ѡ��____________(����ĸ���)��
a��̼�� b��п�� c��ͭ��
�õ绯ѧԭ�����Ͳ���B�趨�ڲ�ԭ��_________________________��
(2)ͼ2�У���բ��C��____________�������Ȼ�����Һģ�⺣ˮ����ʵ�飬DΪʯī�飬��D�ϵĵ缫��ӦʽΪ____________�����õ缫��Ӧ����ķ�����___________________��
(3)þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ��������ͼ3Ϊ��þ���������Ρ�ȼ�ϵ��ԭ��ʾ��ͼ���缫Ϊþ�Ͻ�Ͳ��Ͻ�
��EΪ��ȼ�ϵ�ص�__________��(���������)��F�缫�ϵĵ缫��ӦʽΪ________________________��
��þȼ�ϵ�ظ����������Ը�ʴ����������ʹ���������ʽ��ͣ��û�ѧ���������ԭ��_______________________��
(4)��ȩ��(HOOC��CHO)���л��ϳɵ���Ҫ�м��塣��ҵ���á�˫���ҳɶԵ�ⷨ��������ȩ�ᣬԭ����ͼ4��ʾ����װ��������������Ϊ���Ե缫�������Ҿ��ɲ�����ȩ�ᣬ�����Ҷ�ȩ��M�缫�IJ��ﷴӦ������ȩ�ᡣ
��N�缫�ϵĵ缫��ӦʽΪ____________________________��
������2 mol H��ͨ�����ӽ���Ĥ������ȫ�����˷�Ӧ�����װ�������ɵ���ȩ��Ϊ____________mol��
���𰸡�(1)b п����ԭ��صĸ�����(ʧ���ӣ�Zn��2e��=Zn2��)���������ܸ�ʴ���趨�ڲ�
(2)�� 2Cl����2e��=Cl2�� ʪ��ĵ��۵⻯����ֽ����������������ֽ������֤����������
(3)���� ClO����2e����H2O=Cl����2OH�� ��Mg��2H2O=Mg(OH)2��H2��
(4)��HOOC��COOH��2e����2H��=HOOC��CHO��H2O ��2
��������(1)�γ�ԭ���ʱ��Fe����������������Ҫѡ������Ա�Feǿ�Ľ���������������ѡп��п�Ļ����Ա�Feǿ���������������ܸ�ʴ���趨�ڲ�(2)Fe�����������������բ��C������������Ȼ�����Һʱ������������ʧ����������������缫��ӦΪ��2Cl����2e��=Cl2��������������ʪ��ĵ��۵⻯����ֽ������ʪ��ĵ��۵⻯����ֽ����������������ֽ������֤������������(3)����þ������������ȼ�ϵ����ʧ���ӵ�Ϊ��������MgΪ������������ClO���õ������������ӣ��������ĵ缫��ӦʽΪ��ClO����2e����H2O=Cl����2OH������Mg�Ļ����Խ�ǿ����ˮ��Ӧ�����������䷴ӦΪ��Mg��2H2O=Mg(OH)2��H2����(4)��N�缫��HOOC��COOH�õ�������HOOC��CHO����缫��ӦʽΪHOOC��COOH��2e����2H��=HOOC��CHO��H2O����2 mol H��ͨ�����ӽ���Ĥ��������ת��2 mol���ӣ����ݵ缫����ʽHOOC��COOH��2e����2H��=HOOC��CHO��H2O����֪����1 mol��ȩ�ᣬ��������������ȩ�����ɣ��������ɵ���ȩ��Ϊ2 mol��