题目内容
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中第一电离最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_______,F2+的基态价电子排布式为_________。
(3)BA3-离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为__________。
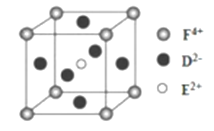
(4)某化合物晶胞结构如图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。
(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式_____________。
【答案】 3 sp3 3d2 三角锥形  6 0.315(或0.223) 水分子间存在氢键 2H2O+ + SO2 ==== 4H+ + SO42—
6 0.315(或0.223) 水分子间存在氢键 2H2O+ + SO2 ==== 4H+ + SO42—
【解析】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素,A元素原子的核外电子数等于其电子层数,A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2,B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca;F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,则F为Ti。
(1)C、N、O中第一电离最大的元素为N元素,其基态原子核外电子排布式为1s22s22p3,有3种不同能量的电子;(2)G为H2O2,O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为sp3,O原子杂化方式为sp3,Ti2+的基态价电子排布式为3d2;(3)CH3-离子中C原子孤电子对数=(4+11×3)/2=1,价层电子对数=3+1=4,故离子的空间构型为三角锥形,与其互为等电子体的一种阳离子为H3O+,电子式为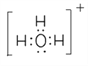 ;(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2-离子相邻,E2+的最近且等距的D2-有6个;根据晶胞结构,K与O间的最短距离是面对角线的一半,即为
;(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2-离子相邻,E2+的最近且等距的D2-有6个;根据晶胞结构,K与O间的最短距离是面对角线的一半,即为![]() nm=0.315nm;如果晶胞中K、I、O分别处于体心、顶角、面心位置,则K与O间的最短距离为边长的一半,即为0.223nm。(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+;水分子间能形成“网”的原因是:水分子间存在氢键;由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O+ +SO2=4H+ + SO42-。
nm=0.315nm;如果晶胞中K、I、O分别处于体心、顶角、面心位置,则K与O间的最短距离为边长的一半,即为0.223nm。(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+;水分子间能形成“网”的原因是:水分子间存在氢键;由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O+ +SO2=4H+ + SO42-。