题目内容
(7分)(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S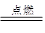 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
(7分) (1)①O>N>C>K
②K2S电子式(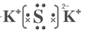 ); sp ③1:1
(2)3d84s2; 4
); sp ③1:1
(2)3d84s2; 4
【解析】(1)由元素守恒可知A为K2S;CO2为直线型分子,中心原子C轨道杂化类型为sp;
HCN分子:H-C≡N,含有两个σ键与两个π键
(2)符合条件的元素只能是第四周期的VIII族元素Fe与Ni

 出彩同步大试卷系列答案
出彩同步大试卷系列答案(7分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________,K值大小与温度的关系是:温度升高,K值________(填增大、减小、可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g) CO2(g)十H2 (g) △H<0。CO和H2O浓度变化如下右图,则 0—4min的平均反应速率v(CO)=______mol/(L·min)
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 |
|
| 6 | 0.096 | 0.266 | 0.104 |
|
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上左表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
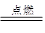 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平) A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平) A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)