题目内容
顺式乌头酸是一种重要的食用增味剂,其结构如下图所示。下列说法正确的是
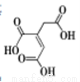
A.该有机物的分子式为:C6H8O6
B.该有机物只含有一种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.等物质的量的顺式乌头酸分别与足量的NaHCO3和Na反应,产生相同条件下的气体体积之比为2:1
| A. | 用无色试剂瓶盛放浓硝酸 | B. | 用铁质容器盛放浓硫酸 | ||
| C. | 用玻璃试剂瓶盛放氢氟酸 | D. | 用带橡胶塞的试剂瓶盛放苯 |
碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
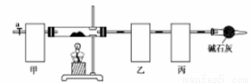
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)
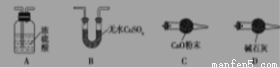
甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。
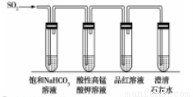
①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
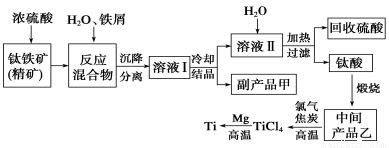
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
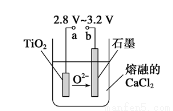
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。
| A. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 某吸热反应能自发进行,因此该反应是熵增反应 |


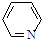 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.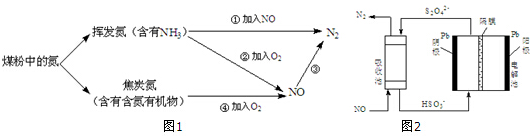
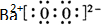 (写电子式),
(写电子式), 液pH=4
液pH=4