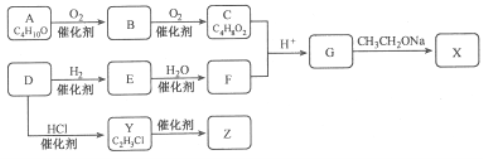
题目内容
【题目】向一定量的Fe、FeO,Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现,则原混合物中铁元素的质量为( )
A.5.6g
B.2.8g
C.11.2g
D.1.4g
【答案】B
【解析】解:用盐酸溶解后,得到的产物加 KSCN 溶液,无血红色出现,说明得到的产物是氯化亚铁,即混合物中的铁元素全在氯化亚铁中,
盐酸的物质的量为1mol.L﹣1×0.1L=0.1mol,
根据氯元素守恒,则n(Fe)=n(FeCl2)= ![]() ×n(HCl)=0.05mol,
×n(HCl)=0.05mol,
则混合物中Fe元素的质量为m(Fe)=0.05mol×56g/mol=2.8g,
故选B.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目