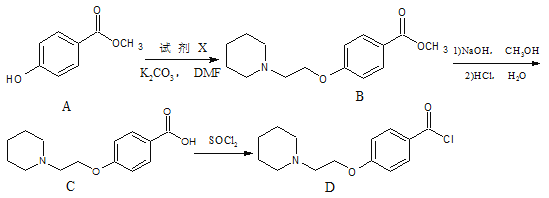
题目内容
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。

(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是______________。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
①已知: Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=__________mol/L。
②计算KClO4样品的纯度(请写出计算过程。)
【答案】(1)1.344;
(2)低温时,KClO3溶解度小,从溶液中结晶析出;(3)97.38%。
【解析】
试题分析:(1)根据得失电子数目守恒,2.13×[5-(-1)]/106.5=V(H2)×2/22.4,解得V(H2)=1.344L;
(2)根据温度和溶解度之间的关系,KClO3的溶解度小于NaClO3,,因此低温时,KClO3的溶解度从溶液中结晶中析出;
(3)①Ksp(Ag2CrO4)=c2(Ag+)×c(CrO42-),求的溶液中c(Ag+)=1×10-4mol·L-1,Ksp(AgCl)=c(Ag+)×c(Cl-),代入数值的c(Cl-)=1.8×10-6mol·L-1;②根据上述推断,先生成AgCl沉淀,因为KClO4中混有少量的KCl,因此有KCl~AgCl,因此总的n(KCl)=21×10-3×0.2mol=4.2×10-3mol,根据氯元素守恒,则有:n(KClO4)+ n(KCl)=0.0042 mol,根据题意得出:n(KClO4) ×138.5 g·mol-1+ n(KCl) ×74.5 g·mol-1=5.689×25/250mol,解得n(KClO4)=0.004mol,n(KCl)=0.0002mol,因此KClO4的质量分数为0.004 × 138.5 / 0.56890 × 100% = 97.38%。

【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是: ,非金属性最强的是 (填具体元素符号,下同)。
(2)元素⑤的氢氧化物与盐酸反应的离子方程式_____ ____。
(3)用电子式表示元素④与⑦的化合物的形成过程: 。