题目内容
19.下列物质中含有离子键的是( )| A. | H2 | B. | CO2 | C. | NH3 | D. | NaCl |
分析 活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物、铵盐中都含有离子键,据此分析解答.
解答 解:A.氢气分子中H-H原子之间只存在共价键,为单质,故A错误;
B.二氧化碳分子中C-O原子之间只存在共价键,属于共价化合物,故B错误;
C.氨气分子中N-H原子之间只存在共价键,属于共价化合物,故C错误;
D.NaCl中钠离子和氯离子之间只存在离子键,为离子化合物,故D正确;
故选D.
点评 本题考查离子键和共价键判断,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可解答,注意二者区别,题目难度不大.

练习册系列答案
相关题目
9.以下物质属于弱电解质的是( )
| A. | 盐酸 | B. | CH3COONH4 | C. | CH3COOH | D. | CI2 |
10.下列关于有机物的叙述正确的是( )
| A. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| B. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同种物质 | |
| D. | 羧基、醛基、羟基、乙基都属于有机物的官能团 |
7.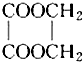 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
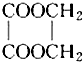 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
| A. | ②③①⑤④ | B. | ②③⑤④① | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
4.下列反应,属于氧化还原反应的是( )
| A. | 2Na2O2+2CO2=2Na2CO3+O2 | B. | Na2O+CO2=Na2CO3 | ||
| C. | 2NaOH+CO2=Na2CO3+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O |
11.下列反应,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2-→CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O |
8.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe-3e-═Fe3+ |
 如图表示一个电解池,a是饱和NaCl溶液;X、Y都是石墨电极,U形管内滴入了几滴酚酞试液.请回答以下问题:
如图表示一个电解池,a是饱和NaCl溶液;X、Y都是石墨电极,U形管内滴入了几滴酚酞试液.请回答以下问题: 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:
原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题: ,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;
,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;