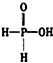题目内容
10.红葡萄酒密封时间越长,则香味越浓郁,其原因是久置的葡萄酒中,与原来相比含有更多的( )| A. | (C6H10O5)n | B. | CH3CH2OH | C. | CH3COOH | D. | CH3COOC2H5 |
分析 红葡萄酒密封储存时间越长,质量越好,其原因是储存过程中乙醇被氧化生成乙酸,乙酸与乙醇反应生成了有香味的酯.
解答 解:红葡萄酒中含有乙醇,乙醇不断氧化最终生成了酸,乙醇能与乙酸发生取代反应生成了乙酸乙酯,
故选D.
点评 本题主要考查了乙醇的性质,为高频考点,侧重于学生的分析能力的考查,抓住醇氧化成醛,醛氧化成酸,醇能与酸反应生成酯是解题的关键.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
20.按电子排布,可把周期表里的元素划分成5个区,区的名称来自按构造原理最后填入电子的能级符号,5个区分别为s区、d区、p区、ds区和f区.电子构型为[Xe]4f145d76s2的元素位于周期表中的哪个区( )
| A. | s区 | B. | d区 | C. | f区 | D. | ds区 |
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
(1)写出下列元素的名称:B氧,E氯;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
18.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)A在周期表中的位置是第一周期ⅠA族,
(2)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;
b的化学式为Na2O2和Na2C2(写一种即可);
c的电子式为 .
.
(1)A在周期表中的位置是第一周期ⅠA族,
(2)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
b的化学式为Na2O2和Na2C2(写一种即可);
c的电子式为
 .
.
5.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8mol•L-1和5.4mol•L-1,在一定的条件下发生反应N2(g)+3H2(g)?2NH3(g).10min后测得N2的浓度是0.8mol•L-1,则在这10min内NH3的平均反应速率是( )
| A. | 0.1mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 0.3mol•L-1•min-1 | D. | 0.2mol•L-1•min-1 |
15.下列气态氢化物最不稳定的是( )
| A. | SiH4 | B. | PH3 | C. | H2S | D. | HF |
2.常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2.若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是( )
| A. | 10:1 | B. | 1:10 | C. | 9:1 | D. | 1:9 |
20.下列物质属于纯净物的是( )
| A. | 医用酒精 | B. | 蒸馏水 | C. | 漂白粉 | D. | 空气 |
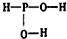
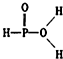
 已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )
已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )