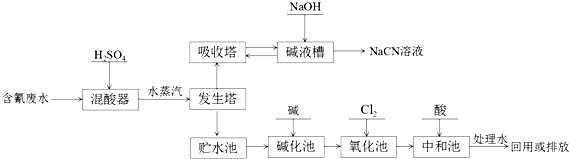
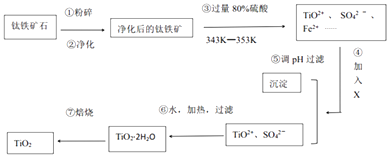
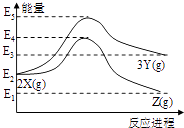
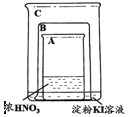
题目内容
【题目】某次酸雨的分析数据如下:c(NH ![]() )=2.0×10﹣4molL﹣1 , c(Na+)=1.9×10﹣4molL﹣1 , c(SO
)=2.0×10﹣4molL﹣1 , c(Na+)=1.9×10﹣4molL﹣1 , c(SO ![]() )=2.8×10﹣4molL﹣1 , c(Cl﹣)=6.0×10﹣4molL﹣1 , c(NO
)=2.8×10﹣4molL﹣1 , c(Cl﹣)=6.0×10﹣4molL﹣1 , c(NO ![]() )=2.3×10﹣4molL﹣1 . 则此次酸雨的pH约为( )
)=2.3×10﹣4molL﹣1 . 则此次酸雨的pH约为( )
A.3
B.4
C.5
D.6
【答案】A
【解析】解:溶液中阴阳离子所带电荷相等,设氢离子浓度为C,所以c (NH ![]() )+c (Na+)+C(H+)=c (NO
)+c (Na+)+C(H+)=c (NO ![]() )+2×c (SO
)+2×c (SO ![]() )+c(Cl﹣),2×10﹣4mol/L+1.9×10﹣4mol/L+C(H+)=2.3×10﹣4mol/L+2×2.8×10﹣4mol/L+6×10﹣4mol/L,所以C(H+)=10﹣3 mol/L,pH=3, 故选A.
)+c(Cl﹣),2×10﹣4mol/L+1.9×10﹣4mol/L+C(H+)=2.3×10﹣4mol/L+2×2.8×10﹣4mol/L+6×10﹣4mol/L,所以C(H+)=10﹣3 mol/L,pH=3, 故选A.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目