题目内容
目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钾同周期,下列关于硒的有关描述中错误的是
| A.原子序数34 | B.最高价氧化物为SeO2 |
| C.原子半径比钾小 | D.气态氢化物化学式为H2Se |
B
试题分析:A、氧位于第二周期第ⅥA族,钙位于第四周期第ⅡA族,硒与氧同主族,而与钙同周期,故硒位于周期表第四周期第VIA族,故A正确;
B、硒位于第ⅥA族,最高正化合价为+6价,硒的最高价氧化物为三氧化硒,是酸性氧化物,故B错误;
C、硒与钙同周期,同周期随着原子序数的增大,原子半径减小,故硒的原子半径小,故C正确;
D、硒的最低负化合价为-2价,形成的气态氢化物为H2Se,故D正确。
故选B。
点评:本题考查了硒元素在元素周期表中的位置,根据钙元素和氧元素来推断,硒元素的原子半径、氢化物和最高价氧化物等来解答。

练习册系列答案
相关题目

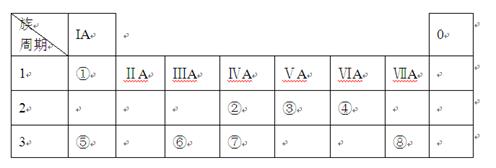
 (2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。


