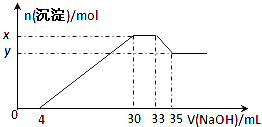
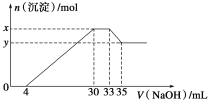
题目内容
【题目】(12分)工业上采用乙苯脱氢制备苯乙烯,反应体系同时发生两步可逆反应,其能量变化情况如下:
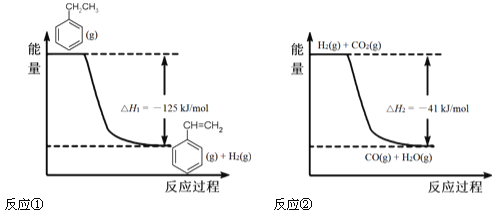
(1)总反应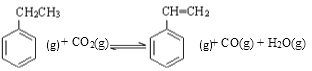 ,△H=_________。
,△H=_________。
(2)下列叙述不能说明反应体系已达到平衡状态的是_______。
A.v正(CO)=v逆(CO) B.消耗1molCO2同时生成1molH2O
C.c(CO2)=c(CO) D.混合气体的平均相对分子质量保持不变
(3)某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应
(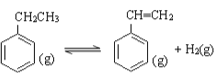 )的影响,并设计了如下实验:
)的影响,并设计了如下实验:
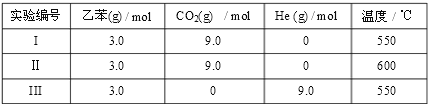
①乙苯脱氢反应的化学平衡常数表达式为______________。
②a=___________________。
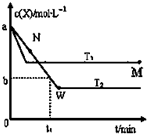
③经实验测得,三组实验中乙苯的转化随时间变化如右图所示。其中未知曲线代表的是实验____(填“Ⅱ”或“III”)。请用平衡移动原理解释该条件改变对乙苯转化率产生影响的原因:______________。
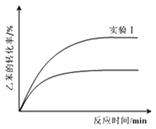
【答案】(1)-166 kJ/mol; (2)BC; (3)①![]() ; ②9.0; ③Ⅲ ;通入CO2,CO2与H2反应,c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高
; ②9.0; ③Ⅲ ;通入CO2,CO2与H2反应,c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高
【解析】
试题分析:(1)根据盖斯定律可知反应①+反应②得到: ,所以该反应的反应热为:△H=△H1+△H2=-125kJ/mol-41kJ/mol=-166 kJ/mol;
,所以该反应的反应热为:△H=△H1+△H2=-125kJ/mol-41kJ/mol=-166 kJ/mol;
(2)A.v正(CO)=v逆(CO),正、逆反应速率的比值恒定,说明正逆反应速率是相等的,所以达到了化学平衡状态,A错误;B.消耗1mol CO2同时生成1mol H2O,只能表示反应的正方向速率,不能说明正逆反应速率相等,B正确;C.c(CO2)=c(CO)不是化学平衡状态的特征,C正确;D.反应前后气体物质的量改变,质量守恒,混合气体的平均相对分子质量会改变,当M不变化,证明达到了平衡,D错误;答案选BC;
(3)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该化学反应的平衡常数表达![]() ;
;
②实验III使用9.0molHe,在改变CO2用量的同时,可以保持反应体系的压强不变;
③根据图2所示未知曲线中,乙苯的转化率降低,化学反应逆向移动,实验Ⅲ符合图示信息,对于平衡: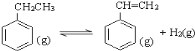 ,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高。
,通入CO2,CO2与H2反应,使c(H2)下降,平衡向正反应方向移动,乙苯的转化率提高。