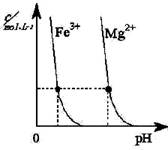
题目内容
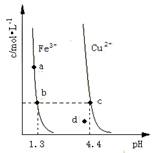
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是

- A.Kap[Fe(OH)3]<Kap[Cu(OH)2]
- B.加适量NH4Cl固体可使溶液由a点变到b点
- C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
- D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
B
试题分析:由题意知当金属阳离子浓度相等时,溶液中OH-的浓度分别为10-12.7和10-9.6,若设金属阳离子浓度为x,则Ksp[Fe(OH)3]=x·(10-12.7)3,Ksp[Cu(OH)2]=x·(10-96)3,显然Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A正确;a 点变到b点溶液的酸性减弱,但NH4Cl溶于水是显酸性的,因此B错误;只要温度不变Kw就是不变的,C正确;溶度积曲线上的每一点都代表饱和点,而b、c两点分别在曲线上,所以此时溶液达到饱和,曲线左下方的是不饱和点,右上方的是过饱和点,D正确,答案选B。
考点:考查溶度积常数的有关计算和判断以及图像识别等
点评:该题难较大,对学生的思维能力要求较高,不易得分。该题的关键是理解溶度积常数的含义和表达式,该题有利于培养学生严谨的逻辑思维能力,提高学生综合解题能力。
试题分析:由题意知当金属阳离子浓度相等时,溶液中OH-的浓度分别为10-12.7和10-9.6,若设金属阳离子浓度为x,则Ksp[Fe(OH)3]=x·(10-12.7)3,Ksp[Cu(OH)2]=x·(10-96)3,显然Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A正确;a 点变到b点溶液的酸性减弱,但NH4Cl溶于水是显酸性的,因此B错误;只要温度不变Kw就是不变的,C正确;溶度积曲线上的每一点都代表饱和点,而b、c两点分别在曲线上,所以此时溶液达到饱和,曲线左下方的是不饱和点,右上方的是过饱和点,D正确,答案选B。
考点:考查溶度积常数的有关计算和判断以及图像识别等
点评:该题难较大,对学生的思维能力要求较高,不易得分。该题的关键是理解溶度积常数的含义和表达式,该题有利于培养学生严谨的逻辑思维能力,提高学生综合解题能力。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
| A.Kap[Fe(OH)3]<Kap[Cu(OH)2] |
| B.加适量NH4Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |

 CO(g)+H2(g);ΔH=
。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=
。(用含ΔH1、ΔH2的代数式表示)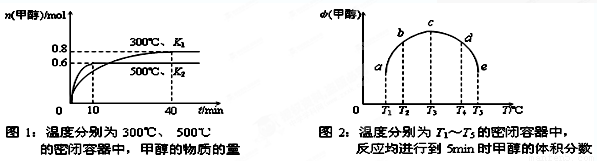

 点变到
点变到 点
点
 两点代表的溶液中
两点代表的溶液中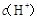 与
与 乘积相等
乘积相等