题目内容
为了测定小苏打样品的变质情况,取13.7g固体样品加到100mL盐酸溶液中,恰好完全反应.产生的气体体积如图所示.请计算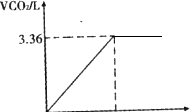
(1)所用盐酸的物质的量浓度.
(2)所取小苏打样品纯度.

(1)所用盐酸的物质的量浓度.
(2)所取小苏打样品纯度.
n(CO2)=
=0.15mol,
设混合物中含有xmolNa2CO3,ymolNaHCO3,
则
,
解之得:x=0.05,y=0.1,
(1)与盐酸分别发生:Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O,
则消耗盐酸的物质的量为n(HCl)=2n(Na2CO3)+n(NaHCO3)=2×0.05mol+0.1mol=0.2mol,
c(HCl)=
=2mol/L,
答:所用盐酸的物质的量浓度为2mol/L,
(2)n(NaHCO3)=0.1mol,
则m(NaHCO3)=0.1mol×84g/mol=8.4g,
ω(NaHCO3)=
×100%=61.3%,
答:所取小苏打样品纯度为61.3%.
| 3.36L |
| 22.4L/mol |
设混合物中含有xmolNa2CO3,ymolNaHCO3,
则
|
解之得:x=0.05,y=0.1,
(1)与盐酸分别发生:Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O,
则消耗盐酸的物质的量为n(HCl)=2n(Na2CO3)+n(NaHCO3)=2×0.05mol+0.1mol=0.2mol,
c(HCl)=
| 0.2mol |
| 0.1L |
答:所用盐酸的物质的量浓度为2mol/L,
(2)n(NaHCO3)=0.1mol,
则m(NaHCO3)=0.1mol×84g/mol=8.4g,
ω(NaHCO3)=
| 8.4g |
| 13.7g |
答:所取小苏打样品纯度为61.3%.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目