题目内容
12.某配位化合物的水溶液为深蓝色,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl,回答下列问题.(1)元素D在周期表中的位置是第三周期ⅥA族.
(2)该配位化合物的化学式为[Cu(NH3)4]SO4•H2O.
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为H-N=N-H.
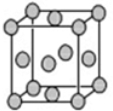
(5)已知E的晶胞结构如下图所示,则E的配位数12;EDC4常作电镀液,其中DC42-的空间构型是正四面体,其中D原子的杂化轨道类型是sp3杂化.
分析 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,据此进行解答.
解答 解:某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,
(1)D为S元素,其原子序数为16,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2,由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶,
故答案为:H2O与H2O2之间形成氢键;
(4)A元素与B元素可形成分子式为H2N2的化合物,该化合物的分子具有平面结构,应存在N=N双键,则其结构式为:H-N=N-H,
故答案为:H-N=N-H;
(5)根据晶胞结构可知,该晶胞为面心立方结构,所以铜原子的配位数为12;CuSO4常作电镀液,其中SO42-中S原子价层电子对数=4+$\frac{6+2-2×4}{2}$=4,S原子不含孤对电子,故其为正四面体构型,S原子采取sp3杂化,
故答案为:12;正四面体;sp3杂化.
点评 本题是对物质结构与性质的考查,题目难度中等,试题涉及元素化合物推断、氢键、结构式、微粒构型判断、杂化轨道、晶胞计算等知识点,解答关键是根据配位化合物为深蓝色晶体进行推断,试题培养了学生的分析、理解能力.

 寒假学与练系列答案
寒假学与练系列答案| A. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| B. | 4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA | |
| C. | 甲基(-CH3)的电子总数为10NA | |
| D. | 在常温常压下,2.24 L丁烷和2-甲基丙烷的混合气体所含分子数为0.1NA |
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
| A. | 检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 | |
| B. | 为增强高锰酸钾的氧化能力,向高锰酸钾溶液中加入稀硝酸酸化 | |
| C. | 检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 | |
| D. | 检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |
| A. | 钠融法 | B. | 铜丝燃烧法 | C. | 核磁共振法 | D. | 红外光谱法 |
| A. | 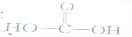 | B. | KSCN | C. | 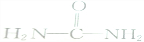 | D. | NH4HCO3 |