题目内容
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式______.
(2)若将(1)中的反应设计成原电池,请在右边方框内画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应______负极反应______
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤______
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
【答案】分析:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液;
(3)先将将Fe2+转化成Fe3+;再根据图表条件溶液的pH值,三价铁离子沉淀完全后,进行过滤即可;
(4)根据劣质不锈钢能与某些盐溶液反应而被腐蚀,所以要根据所给药品制取盐溶液,制取盐溶液时要考虑环保,且该盐溶液与铁反应时有明显的现象.
解答:解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为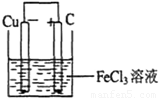 ,故答案为:
,故答案为: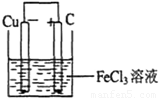 ;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
(3)根据图表知,Fe3+沉淀需要的PH值较小,与铜离子沉淀时的PH值相差较大,所以首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气 作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在PH值3.2时三价铁离子完全沉淀,PH值4.7时铜离子开始沉淀,所以调节溶液的PH值至3.2-4.7;然后通过过滤除去生成的沉淀.
故答案为:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2-4.7;③过滤(除去Fe(OH)3).(4)劣质不锈钢能与某些盐溶液反应而被腐蚀,给取的药品没有盐溶液,所以用给取的药品制取盐溶液,可用铜与浓硫酸反应制取硫酸铜溶液,也可用氧化铜和稀硫酸制取硫酸铜溶液,但铜与浓硫酸反应生成有毒气体,不环保,所以用氧化铜和稀硫酸反应制取硫酸铜溶液;硫酸铜和铁反应产生铜单质,所以可观察到不锈钢表面有紫红色物质生成.
故答案为:CuO+H2SO4=CuSO4+H2O、CuSO4+Fe=FeSO4+Cu;不锈钢表面有紫红色物质生成.
点评:本题考查了原电池的工作原理及原电池的设计,难度较大,原电池的设计是学习的重点和难度.
(2)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液;
(3)先将将Fe2+转化成Fe3+;再根据图表条件溶液的pH值,三价铁离子沉淀完全后,进行过滤即可;
(4)根据劣质不锈钢能与某些盐溶液反应而被腐蚀,所以要根据所给药品制取盐溶液,制取盐溶液时要考虑环保,且该盐溶液与铁反应时有明显的现象.
解答:解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,故答案为:
,故答案为: ;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);(3)根据图表知,Fe3+沉淀需要的PH值较小,与铜离子沉淀时的PH值相差较大,所以首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气 作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在PH值3.2时三价铁离子完全沉淀,PH值4.7时铜离子开始沉淀,所以调节溶液的PH值至3.2-4.7;然后通过过滤除去生成的沉淀.
故答案为:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2-4.7;③过滤(除去Fe(OH)3).(4)劣质不锈钢能与某些盐溶液反应而被腐蚀,给取的药品没有盐溶液,所以用给取的药品制取盐溶液,可用铜与浓硫酸反应制取硫酸铜溶液,也可用氧化铜和稀硫酸制取硫酸铜溶液,但铜与浓硫酸反应生成有毒气体,不环保,所以用氧化铜和稀硫酸反应制取硫酸铜溶液;硫酸铜和铁反应产生铜单质,所以可观察到不锈钢表面有紫红色物质生成.
故答案为:CuO+H2SO4=CuSO4+H2O、CuSO4+Fe=FeSO4+Cu;不锈钢表面有紫红色物质生成.
点评:本题考查了原电池的工作原理及原电池的设计,难度较大,原电池的设计是学习的重点和难度.

练习册系列答案
相关题目