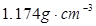题目内容
已知某KOH样品中含水7.62%,含K2CO32.23%,含KOH 90%。现将1.00g样品加入46.00mL1.00mol/L的盐酸中,过量的酸用1.070mol/L KOH溶液刚好中和。蒸发溶液,蒸发到无水时,可得到固体的质量约为
| A.3.00g | B.3.43g | C.4.50g | D.无法计算 |
B
由题意可知,不管溶液中发生如何反应,最后得到的溶质固体是氯化钾。只需求出溶液中有多少物质的量的盐酸就有多少氯化钾,即46×0.001×(39+35.5)=3.427 g. 所以选B。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
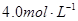 ,则下列说法中不正确的是
,则下列说法中不正确的是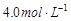
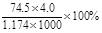
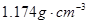 的KCl溶液是不饱和溶液
的KCl溶液是不饱和溶液