题目内容
(12分)⑴① NH3 ②SO3 ③Cl2 ④BaSO4 ⑤酒精 ⑥CH3COONH4 ⑦HClO ⑧Cu。
以上物质中属于非电解质的是 ,属于强电解质的是 。
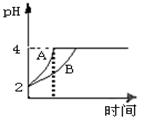
⑵常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”),设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(填“<”、“=”、“>”)。
⑶在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液。若a + b>15,则Va∶Vb = (填表达式),且Va Vb(填“>”“<”或“=”)
⑴① ② ⑤;④ ⑥。 ⑵B;< ⑶Va/Vb=1×10a+b-14; >
【解析】(1)溶于水和熔融状态下均不能导电的化合物是非电解质,所以答案是① ② ⑤。在溶液中能完全电离的电解质是强电解质,因此答案是④⑥。
(2)醋酸是弱电解质,存在电离平衡。在醋酸和锌的反应过程中,醋酸会继续电离出氢离子,所以在pH相等的条件下,醋酸溶液的pH变化程度小,因此B表示的是醋酸。由于在反应过程中醋酸会继续电离出氢离子,所以在pH变化相同的条件下,醋酸消耗的锌要多。
(3)如果盐酸 的物质的量大于氢氧化钠的,则盐酸过量,溶液显酸性,反之显碱性。相等则显中性。若二者恰好完全反应时,则Va×10-a=Vb×1×10—14÷10—b,解得Va/Vb=1×10a+b-14。若a + b>15,则Va/Vb>10。

| 分子或离子 | 孤对电子对数 | 杂化轨道数 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | ||
| NH3 | ||||||
| BeCI2 | ||||||
| SO3 | ||||||
NH
|
||||||
SO
|
||||||
| NCI2 |