题目内容
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
【答案】C
【解析】在同温同压下,气体的物质的量之比等于体积之比,所以8gCO和CO2的混合气体的物质的量为1mol/4=0.25mol。根据题意可得n(CO)+n(CO2)=0.25mol,28g/mol×n(CO)+44g/mol×n(CO2)=8g,解得n(CO)=0.1875mol,n(CO2)=0.0625mol,所以n(CO):n(CO2)=3:1,故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下表为元素周期表的一部分。请回答下列问题:
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | |||||||||||||||
⑧ | ⑨ | ||||||||||||||||
(1)上述元素中,属于d区的是________(填元素符号)。
(2)写出元素⑨的基态原子的价电子排布式___________________________。
(3)元素第一电离能为③___④,电负性③___④(填“>”或“<”)。
(4)元素③气态氢化物分子为_______分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_______________________________________。
(5)元素⑥的单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示.
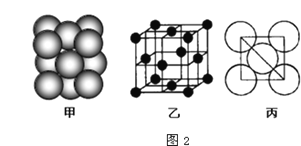
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数的值,元素⑥的相对原子质量为M,则一个晶胞中⑥原子的个数为______,该晶体的密度为_________(用M、NA、d表示).
