题目内容
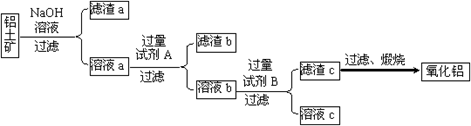
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图

⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响____________________________________________________________。

⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响____________________________________________________________。
⑴盐酸(硫酸、硝酸) Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O
⑵NaOH H++OH-=H2O Fe3++3OH-=Fe(OH)3 ↓ Al3++4OH-=AlO2-+2H2O
⑶NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
⑷若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
⑵NaOH H++OH-=H2O Fe3++3OH-=Fe(OH)3 ↓ Al3++4OH-=AlO2-+2H2O
⑶NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
⑷若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
(1)石灰石煅烧的生成物是CO2,这说明步骤③中加入的是CO2,所以滤液②中含有偏铝酸钠。因此原料B是氢氧化钠,则滤液①中氯化铝,所以试剂①是盐酸(或稀硫酸、硝酸等)。二氧化硅与酸是不反应的,所以步骤①中的离子方程式是
Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(2)滤液①中含有过量的盐酸,以及生成的氯化铝和氯化铁,所以加入过量的氢氧化钠时反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3 ↓、Al3++4OH-=AlO2-+2H2O。
(3)滤液③中含有过量的氢氧化钠以及生成的偏铝酸钠,所以通入过量的CO2时的化学方程式是NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后在生成的氢氧化铝中混有硅酸沉淀,硅酸分解生成二氧化硅,使加热制得的Al2O3混有SiO2杂质,所以不能省去步骤①。
Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(2)滤液①中含有过量的盐酸,以及生成的氯化铝和氯化铁,所以加入过量的氢氧化钠时反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3 ↓、Al3++4OH-=AlO2-+2H2O。
(3)滤液③中含有过量的氢氧化钠以及生成的偏铝酸钠,所以通入过量的CO2时的化学方程式是NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后在生成的氢氧化铝中混有硅酸沉淀,硅酸分解生成二氧化硅,使加热制得的Al2O3混有SiO2杂质,所以不能省去步骤①。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
 AlN + CO(配平)
AlN + CO(配平)
 )中,铝的作用是( )
)中,铝的作用是( )