题目内容
下列说法不正确的是( )
| A.漂白粉长时间露置空气中会变质失效 |
| B.澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C.高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D.金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
B
解析试题分析:A选项,正确,漂白粉久置空气会失效(涉及两个反应):Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO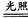 2HCl+O2↑,漂白粉变质会有CaCO3存在,外观上会结块。;B选项,不正确,与Ca(OH)2溶液反应:Na2CO3、NaHCO3溶液中均有白色沉淀生成;C选项,正确,较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,因为C比Si非金属性强,碳酸比硅酸酸性强;由此对于反应Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2
2HCl+O2↑,漂白粉变质会有CaCO3存在,外观上会结块。;B选项,不正确,与Ca(OH)2溶液反应:Na2CO3、NaHCO3溶液中均有白色沉淀生成;C选项,正确,较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,因为C比Si非金属性强,碳酸比硅酸酸性强;由此对于反应Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2 Na2SiO3+CO2↑居然也能进行,这是因为在高温反应条件下高沸点制低沸点(也可看成熵增,动力学因素);D选项,正确,金属腐蚀的本质主要是金属原子失电子被氧化,腐蚀主要有化学腐蚀和电化学腐蚀,两者的区别是当电化学腐蚀发生时,金属表面存在隔离的阴极与阳极,有微小的电流存在于两极之间,单纯的化学腐蚀则不形成微电池。
Na2SiO3+CO2↑居然也能进行,这是因为在高温反应条件下高沸点制低沸点(也可看成熵增,动力学因素);D选项,正确,金属腐蚀的本质主要是金属原子失电子被氧化,腐蚀主要有化学腐蚀和电化学腐蚀,两者的区别是当电化学腐蚀发生时,金属表面存在隔离的阴极与阳极,有微小的电流存在于两极之间,单纯的化学腐蚀则不形成微电池。
考点:考查元素化合物的主要性质,电化学腐蚀的原理。

练习册系列答案
相关题目
如图所示,止水夹开始时处于关闭状态,将液体A滴入试管2中与气体B充分反应,打开止水夹,可发现试管1内的水立刻沸腾了。则液体A和气体B的组合不可能的是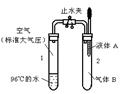
| A.氧氧化钠溶液、二氧化碳 |
| B.水、氨气 |
| C.氢氧化钠溶液、一氧化碳 |
| D.水、二氧化氮 |
类比法是化学学习过程中一种重要方法,以下类比关系正确的是
| A.工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 |
| B.醇和酚中都有羟基,都可以和氢氧化钠溶液反应 |
| C.二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 |
| D.氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )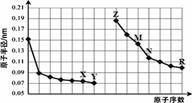
| A.X、R两种元素的气态氢化物的稳定性:R>X |
| B.简单离子的半径:Y > Z > M |
| C.N的单质能与Z的最高价氧化物对应的水化物反应 |
| D.Z与X两种元素形成的化合物都是碱性氧化物 |
实验是化学研究的基础。对下列实验现象的描述错误的是
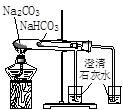 | 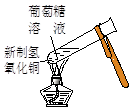 | 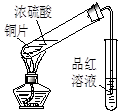 | 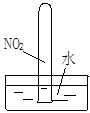 |
| ① | ② | ③ | ④ |
A.实验①烧杯中的澄清石灰水都变浑浊
B.实验②试管中出现砖红色沉淀
C.实验③品红溶液褪色
D.实验④气体由红棕色变为无色,试管中的液面上升
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | Si有导电性 | SiO2可用于制光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有氧化性 | FeCl3溶液可用于溶解回收旧电路板中的铜 |