题目内容
2.已知图中的字母代表中学化学中的常见物质,A是无色液体,B是浓溶液,反应②在高温、高压、催化剂的条件下进行,G是温室气体.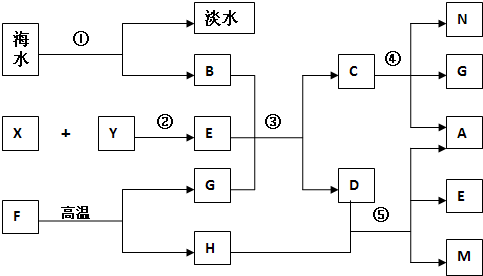
根据图回答下列问题:
(1)海水资源的利用要实现①通常采用蒸馏法法和淡化膜法法等.
(2)写出E的电子式
 、G的结构式为O=C=O;若向M溶液通入G否(是或否)有沉淀,若再通入足量E观察到的现象是有白色沉淀.
、G的结构式为O=C=O;若向M溶液通入G否(是或否)有沉淀,若再通入足量E观察到的现象是有白色沉淀.(3)写出③、④的化学方程式:
③NaCl+NH3+CO2=NaHCO3+NH4Cl④2NaHCO3=CO2↑+Na2CO3+H2O.
分析 B是浓溶液,海水去除氯化钠之后变为淡水,所以B是NaCl浓溶液,G是温室气体,则G为CO2,反应②在高温、高压、催化剂的条件下进行,应为工业合成氨的反应,根据各物质的转化关系,反应③应为候氏制碱法,所以X、Y为氮气和氢气,E为NH3,C分解能产生二氧化碳,则C应为碳酸氢钠,D为氯化铵,碳酸氢钠受热分解得二氧化碳、水、碳酸钠,A是无色液体,则A是水,所以N为碳酸钠,F高温分解生成二氧化碳,则F为碳酸钙,H为氧化钙,H与D的溶液反应生成M为氯化钙,据此答题.
解答 解:B是浓溶液,海水去除氯化钠之后变为淡水,所以B是NaCl浓溶液,G是温室气体,则G为CO2,反应②在高温、高压、催化剂的条件下进行,应为工业合成氨的反应,根据各物质的转化关系,反应③应为候氏制碱法,所以X、Y为氮气和氢气,E为NH3,C分解能产生二氧化碳,则C应为碳酸氢钠,D为氯化铵,碳酸氢钠受热分解得二氧化碳、水、碳酸钠,A是无色液体,则A是水,所以N为碳酸钠,F高温分解生成二氧化碳,则F为碳酸钙,H为氧化钙,H与D的溶液反应生成M为氯化钙,
(1)海水资源的利用要实现①通常采用最常用的为蒸馏法和淡化膜法,
故答案为:蒸馏法;淡化膜法;
(2)根据上面的分析可知,E为NH3,E的电子式为 ,G为CO2,G的结构式为 O=C=O,M为氯化钙,若向M溶液通入CO2没有沉淀,若再通入足量NH3观察到的现象是有白色沉淀,
,G为CO2,G的结构式为 O=C=O,M为氯化钙,若向M溶液通入CO2没有沉淀,若再通入足量NH3观察到的现象是有白色沉淀,
故答案为: ;O=C=O;否;有白色沉淀;
;O=C=O;否;有白色沉淀;
(3)反应③的化学方程式为NaCl+NH3+CO2=NaHCO3+NH4Cl,反应④的化学方程式:2NaHCO3=CO2↑+Na2CO3+H2O,
故答案为:NaCl+NH3+CO2=NaHCO3+NH4Cl;2NaHCO3=CO2↑+Na2CO3+H2O.
点评 本题考查无机物的推断,题目难度不大,本题注意把握物质的分子构成特点以及典型的物理性质,常作为推断题的突破口,答题时注意体会.

 寒假学与练系列答案
寒假学与练系列答案①CS2+3Cl2 $\stackrel{111-140℃}{→}$ CCl4+S2Cl2;②2S+Cl2 $\stackrel{95-100℃}{→}$ S2Cl2.
已知S2Cl2中硫元素显+1价,电子式:
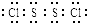 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |

回答下列问题:
(1)装置B、C中玻璃容器的名称:广口瓶;反应原理(填写数字序号):①.
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图).这种冷却方式可应用于下列高中化学中BD实验.
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).
| A. | 504mL | B. | 168mL | C. | 336mL | D. | 224mL |
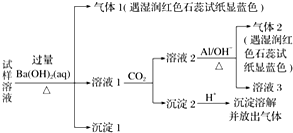
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 试样与Na2CO3溶液一定不能大量共存 | |
| D. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
| A. | 85g | B. | 79g | C. | 116g | D. | 58g |
| A. | 钠跟水 | B. | 氧化钠跟水 | C. | 过氧化钠跟水 | D. | 电解水 |

| A. | 甲为小苏打,乙为纯碱 | |
| B. | 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 | |
| C. | 加热不久就能看到A烧杯的澄清石灰水变浑浊 | |
| D. | 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊 |
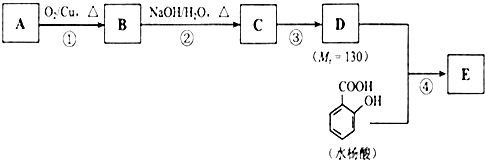
 .
.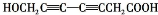 、
、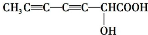 、
、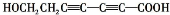 、
、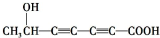 .
.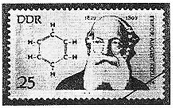 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程.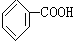 和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式:
和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式: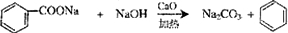 (NaOH参与反应)
(NaOH参与反应)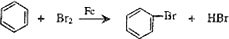
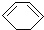 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).