题目内容
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): 。
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: 。
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | |||||
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | ⑨ |
| 4 | ⑩ | | | | | | | |
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): 。
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: 。
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 。
(1)CH4 NH3 H2O (任写两种)。
(2)N>O>C> Na (写元素符号)。
(3)HClO4 KOH电子式:
(4)Al2O3 Al2O3 +2OH- =2AlO 2-+H2O。
(5)A B; D的P轨道全空,能量更低更稳定。
(2)N>O>C> Na (写元素符号)。
(3)HClO4 KOH电子式:

(4)Al2O3 Al2O3 +2OH- =2AlO 2-+H2O。
(5)A B; D的P轨道全空,能量更低更稳定。
试题分析:(1)①~⑩元素分别是H、C、N、O、Na、Al、P、Cl、Ar、K,由元素组成的分子中电子总数为10的分子有CH4 NH3 H2O HF等
(2)②、③、④、⑤元素分别是C、N、O、Na,根据电离能的递变规律,N最外层半充满,第一电离能最大,Na的电子层数最多,第一电离能最小,O、C位居其中,所以第一电离能的大小顺序为N>O>C > Na
(3)元素的非金属性越强,其最高价含氧酸的酸性越强,所以酸性最强是酸是氯元素对应的高氯酸,化学式为HClO4,金属性越强,其最高价氧化物的水化物的碱性越强,所以碱性最强的碱是KOH,其电子式为

(4)具有两性的最高价氧化物是Al2O3;其与氢氧化钠溶液反应的离子方程式:Al2O3 +2OH- =2AlO 2-+H2O
(5)非金属元素的第一电离能比较大,通过表中数据可以判断第一电离能较大的为非金属元素,AB可能属于非金属;E的前三电离能较小,第四电离能突然增大,说明此元素的化合价为+3,为铝元素,而D的第一电离能比E略大且相邻,所以D为镁,原因是镁的p轨道全空,能量更低更稳定

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
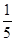 的原子和最外层电子排布为4s24p5的原子
的原子和最外层电子排布为4s24p5的原子