题目内容
【题目】实验室用密度为1.25gmL﹣1 , 质量分数为36.5%的浓盐酸配制240mL 0.1molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 .
(2)配制240mL 0.1molL﹣1的盐酸应量取浓盐酸体积mL,应选用容量瓶的规格mL.
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次).
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)填“偏大”、“偏小”或“无影响”
①用量筒量取浓盐酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 .
②用量筒量取浓盐酸时,仰视读数 .
③定容摇匀后,发现液面下降,继续加水至刻度线 .
④定容时仰视刻度线 .
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线 .
②向容量瓶中转移溶液时不慎有溶液溅出 .
【答案】
(1)12.5mol/L
(2)2.0;250
(3)B、C、A、F、E、D
(4)偏大;偏大;偏小;偏小
(5)重新配制;重新配制
【解析】解:(1)浓盐酸的物质的量浓度C= ![]() =12.5mol/L;所以答案是:12.5mol/L;(2)要配置240ml的溶液,应选择250ml的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L=250mL×0.1molL﹣1 , 解得V=2.0ml;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,根据“大而近”的原则,故应选择250mL容量瓶;所以答案是:2.0;250;(3)浓溶液配置稀溶液的一般操作步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,故配制步骤为BCAFED;所以答案是:BCAFED;(4)①用量筒量取浓盐酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中,会导致溶质偏多,则浓度偏高,所以答案是:偏大;②用量筒量取浓盐酸时,仰视读数,会导致所取的浓盐酸的体积偏大,则配制出的溶液的浓度偏高,所以答案是:偏大;③定容摇匀后,发现液面下降是正常的,继续加水至刻度线,则浓度偏小,所以答案是:偏小;④定容时仰视刻度线,则溶液体积偏大,故浓度偏低,所以答案是:偏小;(5)①加蒸馏水时不慎超过了刻度线,无法补救,故应重新配制,所以答案是:重新配制;②向容量瓶中转移溶液时不慎有溶液溅出,由于不知溅出的溶质的量,故无法补救,应重新配制,所以答案是:重新配制.
=12.5mol/L;所以答案是:12.5mol/L;(2)要配置240ml的溶液,应选择250ml的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L=250mL×0.1molL﹣1 , 解得V=2.0ml;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,根据“大而近”的原则,故应选择250mL容量瓶;所以答案是:2.0;250;(3)浓溶液配置稀溶液的一般操作步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,故配制步骤为BCAFED;所以答案是:BCAFED;(4)①用量筒量取浓盐酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中,会导致溶质偏多,则浓度偏高,所以答案是:偏大;②用量筒量取浓盐酸时,仰视读数,会导致所取的浓盐酸的体积偏大,则配制出的溶液的浓度偏高,所以答案是:偏大;③定容摇匀后,发现液面下降是正常的,继续加水至刻度线,则浓度偏小,所以答案是:偏小;④定容时仰视刻度线,则溶液体积偏大,故浓度偏低,所以答案是:偏小;(5)①加蒸馏水时不慎超过了刻度线,无法补救,故应重新配制,所以答案是:重新配制;②向容量瓶中转移溶液时不慎有溶液溅出,由于不知溅出的溶质的量,故无法补救,应重新配制,所以答案是:重新配制.

【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
C6H12O6溶液 ![]()
![]()
![]()
![]() 悬浊液
悬浊液 ![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是: . 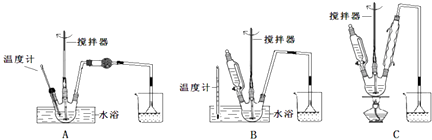
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是 .
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是;本实验中不宜用CaCl2替代CaCO3 , 理由是 .
(3)第③步需趁热过滤,其原因是 .
(4)第④步加入乙醇的作用是 .
(5)第⑥步中,下列洗涤剂最合适的是 .
A.冷水
B.热水
C.乙醇
D.乙醇﹣水混合溶液.