题目内容
【题目】[化学——选修3:物质结构与性质]X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态;Y能形成最强的无机含氧酸,Z的单质是前36号元素中最活泼的金属单质,W的一种核素的质量数是56,中子数是30。
(1)W的稳定价态离子的核外电子排布式为_________,Y、Z、W电负性由大到小的顺序为___________(填元素符号)。
(2)X与同周期相邻的另外两种元素相比其第一电离能最大,原因是_____________________X和与X同族的另外两种前四周期元素的简单氢化物的沸点由低到高的顺序为_______________,试解释其原因__________________
(3)XY3的中心原子轨道杂化类型为_________
(4)已知WY3的沸点为319 ℃,熔点为306 ℃,则WY3的晶体类型为____________Z的重要化合物Z2O2中存在的化学键类型有_______________
A.离子键 B.极性共价键 C.非极性共价键 D.π 键
(5)若Z的晶胞为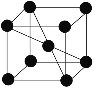 ,Z离子的半径为d cm,则Z单质的密度为_______。
,Z离子的半径为d cm,则Z单质的密度为_______。
【答案】(1)1s22s22p63s23p63d5或[Ar]3d5 Cl>Fe>K
(2)碳元素的非金属性比氮的弱,第一电离能最小,氮元素因其2p能级处于半充满状态,故其第一电离能比氧元素的大 PH3<AsH3<NH3 NH3能形成分子间氢键导致沸点升高,PH3、AsH3均不能形成分子间氢键,又PH3的相对分子质量较AsH3小,其分子间作用力较小,沸点较低(其他合理说法也对)
(3)sp3(1分)(4)分子晶体(1分)ac(1分)(5)![]() g·cm-3
g·cm-3
【解析】
试题分析:X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态,则X的电子排布式为1s22s22p3,即X是N;Y能形成最强的无机含氧酸,所以Y是Cl;Z的单质是前36号元素中最活泼的金属单质,则Z是K;W的一种核素的质量数是56,中子数是30,则质子数=56-30=26,即为Fe。
(1)铁的稳定价态离子是铁离子,其核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;非金属性越强,电负性越大,则Y、Z、W电负性由大到小的顺序为Cl>Fe>K。
(2)碳元素的非金属性比氮的弱,第一电离能最小,氮元素因其2p能级处于半充满状态,故其第一电离能比氧元素的大;由于NH3能形成分子间氢键导致沸点升高,PH3、AsH3均不能形成分子间氢键,又PH3的相对分子质量较AsH3小,其分子间作用力较小,沸点较低,因此简单氢化物的沸点由低到高的顺序为PH3<AsH3<NH3。
(3)NCl3的中心原子N原子的价层电子对数=![]() ,所以轨道杂化类型为sp3。
,所以轨道杂化类型为sp3。
(4)已知FeCl3的沸点为319 ℃,熔点为306 ℃,这说明氯化铁的晶体类型为分子晶体;K的重要化合物K2O2中存在的化学键类型有离子键和非极性键,答案选ac。
(5)根据钾的晶胞可知晶胞中含有8×1/8+1=2个钾原子,钾离子的半径为dcm,则晶胞的边长是![]() ,所以Z单质的密度为
,所以Z单质的密度为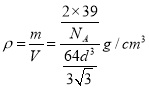 =
=![]() g·cm-3。
g·cm-3。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案