题目内容
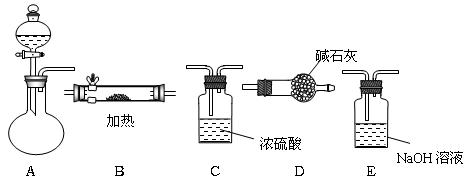
下图是用于气体的制备.干燥.性质实验、尾气处理的常用装置.请根据要求回答下列问题.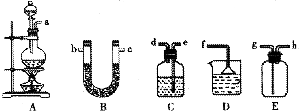
(1)怎样检查装置A的气密性
(2)某同学将仪器连接顺序为A-B-C-D,以此证明实验室制取Cl2的过程中有HCl和水蒸气挥发出来.
①A中的反应化学方程式是
②B中盛放的试剂是
③有同学认为实验有缺陷,应该在C、D之间增加E装置,你认为该装置中.应放入
(3)最后,同学们用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,按气流方向填出接口顺序a→
分析:(1)依据装置中的气体压强变化,利用分液漏斗中的液体液面变化分析判断;
(2)①实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
②检验生成产物中有氯化氢和水蒸气应先检验水的存在,用无水硫酸铜白色变蓝色,再检验氯化氢存在用硝酸银溶液检验,检验前需要吸收氯气防止干扰氯化氢的检验;
③在CD间加装置E是广口瓶检验氯气是否除净,利用氯气的漂白作用;
(3)依据实验室制备氯气中含有氯化氢和水蒸气,利用洗气装置先利用饱和氯化钠溶液吸收氯化氢,再通过浓硫酸吸收水蒸气;
(2)①实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
②检验生成产物中有氯化氢和水蒸气应先检验水的存在,用无水硫酸铜白色变蓝色,再检验氯化氢存在用硝酸银溶液检验,检验前需要吸收氯气防止干扰氯化氢的检验;
③在CD间加装置E是广口瓶检验氯气是否除净,利用氯气的漂白作用;
(3)依据实验室制备氯气中含有氯化氢和水蒸气,利用洗气装置先利用饱和氯化钠溶液吸收氯化氢,再通过浓硫酸吸收水蒸气;
解答:解:(1)装置A中先把a封闭,在分液漏斗中加入水,一段时间后,水不继续下降证明装置气密性完好;
故答案为:先将a接口封闭,然后向分液漏斗中注入水,打开分液漏斗活塞,分液漏斗中水的液面不会连续下降,证明装置A的气密性好;
(2)①实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
②检验生成产物中有氯化氢和水蒸气应先检验水的存在,用无水硫酸铜白色变蓝色,再检验氯化氢存在用硝酸银溶液检验,检验前需要吸收氯气防止干扰氯化氢的检验,B中盛放的试剂是无水硫酸铜粉末,C中盛放的是CCl4溶液,其作用是吸收氯气,防止对HCl检验带来影响,D中盛放的试剂是AgNO3溶液,实验时看到的现象是白色沉淀;
故答案为:无水硫酸铜粉末;吸收氯气,防止对HCl检验带来影响; AgNO3溶液;产生白色沉淀;
③实验有缺陷,应该在C、D之间增加E装置,检验氯气是否除净,利用氯气的漂白作用,可以在广口瓶中加入湿润的淀粉碘化钾或湿润的有色布条,若变蓝或褪色证明氯气未吸收完全,若不变蓝或不褪色证明氯气已经除净;
故答案为:湿润的KI淀粉试纸或湿润的有色布条;
(3)用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,实验室制备氯气中含有氯化氢和水蒸气,利用洗气装置先利用饱和氯化钠溶液吸收氯化氢,再通过浓硫酸吸收水蒸气,连接装置为eded,第一个广口瓶盛饱和食盐水,第二个盛浓硫酸;
故答案为:eded;饱和食盐水、浓硫酸;
故答案为:先将a接口封闭,然后向分液漏斗中注入水,打开分液漏斗活塞,分液漏斗中水的液面不会连续下降,证明装置A的气密性好;
(2)①实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
②检验生成产物中有氯化氢和水蒸气应先检验水的存在,用无水硫酸铜白色变蓝色,再检验氯化氢存在用硝酸银溶液检验,检验前需要吸收氯气防止干扰氯化氢的检验,B中盛放的试剂是无水硫酸铜粉末,C中盛放的是CCl4溶液,其作用是吸收氯气,防止对HCl检验带来影响,D中盛放的试剂是AgNO3溶液,实验时看到的现象是白色沉淀;
故答案为:无水硫酸铜粉末;吸收氯气,防止对HCl检验带来影响; AgNO3溶液;产生白色沉淀;
③实验有缺陷,应该在C、D之间增加E装置,检验氯气是否除净,利用氯气的漂白作用,可以在广口瓶中加入湿润的淀粉碘化钾或湿润的有色布条,若变蓝或褪色证明氯气未吸收完全,若不变蓝或不褪色证明氯气已经除净;
故答案为:湿润的KI淀粉试纸或湿润的有色布条;
(3)用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,实验室制备氯气中含有氯化氢和水蒸气,利用洗气装置先利用饱和氯化钠溶液吸收氯化氢,再通过浓硫酸吸收水蒸气,连接装置为eded,第一个广口瓶盛饱和食盐水,第二个盛浓硫酸;
故答案为:eded;饱和食盐水、浓硫酸;
点评:本题考查了实验室制备氯气的装置分析和反应原理的应用,杂质气体的除去和验证实验设计是解题关键,题目难度中等.

练习册系列答案
相关题目


 (3)
(3)