题目内容
如图所示,A、B、F、M为常见的单质,其中F为黑色固体,其余为化合物,D是可以使湿润的红色石蕊试纸变蓝的气体。完成下列问题: 
(1)写出下列物质的化学式,A_________________;C__________________;E_____________;H________________。
(2)写出A+N,C+H2O的化学方程式:?________________________________________。
(3)写出H的水溶液与D反应的离子方程式:?______________________________________。
(4)写出A单质与热水反应的化学方程式:?________________________________________。
解析:D是可使湿润的红色石蕊试纸变蓝色的气体,故D为NH3,这是本题的突破口。D由C与水反应生成,C为金属氮化物,常见为Mg3N2,则E为Mg(OH)2,G为MgO,A为Mg。
答案:(1)Mg Mg3N2 Mg(OH)2 MgCl2
![]()
Mg3N2+6H2O====2NH3↑+3Mg(OH)2↓
(3)Mg2++2NH3+2H2O====Mg(OH)2↓+2![]()
![]()

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
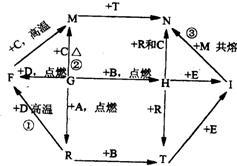 如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
 HCO3-+OH-
HCO3-+OH-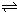 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
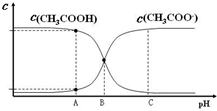
 如图所示,A、B、C、D、E、F为中学化学中的常见物质,其中B为黑色粉末,D为黄绿色气体单质,F为无色气体单质,且F是空气的主要成分,其转化关系如下:
如图所示,A、B、C、D、E、F为中学化学中的常见物质,其中B为黑色粉末,D为黄绿色气体单质,F为无色气体单质,且F是空气的主要成分,其转化关系如下: