题目内容
反应H2(g)+I2(g)?2HI(g)的平衡常数为K1;反应HI(g)?
H2(g)+
I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)( )
| 1 |
| 2 |
| 1 |
| 2 |
分析:化学平衡常数指,一定温度下,可逆达到平衡,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故相同温度下,等于同一反应的正、逆反应平衡常数互为倒数,同一转化关系,化学计量数变为原的n倍,则化学平衡常数为原来的n次方倍,据此解答.
解答:解:反应 H2(g)+I2(g)?2HI(g)的平衡常数K1,
则相同温度下,反应2HI(g)?H2(g)+I2(g)的平衡常数为
,
故反应HI(g)?
H2(g)+
I2(g)的平衡常数K2=(
)
,故K1=
;
故选B.
则相同温度下,反应2HI(g)?H2(g)+I2(g)的平衡常数为
| 1 |
| K1 |
故反应HI(g)?
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| K1 |
| 1 |
| 2 |
| 1 |
| K22 |
故选B.
点评:本题考查平衡常数的书写、计算等,比较基础,注意根据化学平衡常数的书写进行理解计算.

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )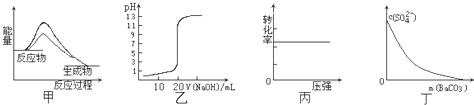

| A、图甲表示使用催化剂后,该反应的△H变小 | B、图乙表示0.10mol?L-1NaOH溶液滴定20.00mL 0.10mol?L-1CH3COOH溶液所得到的滴定曲线 | C、图丙表示反应H2(g)+I2(g)?2HI(g)中H2的转化率随压强的变化 | D、图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(SO42-)的浓度变化 |