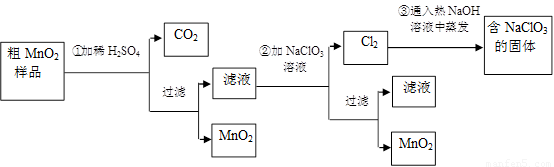
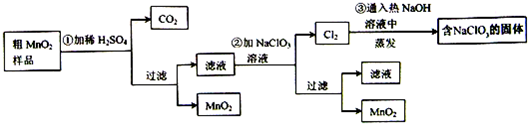
��Ŀ����
MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڣ�ij�о���ѧϰС������˽���MnO2(���н϶��MnO��MnCO3)��Ʒת��Ϊ��MnO2��ʵ�飬���������£�

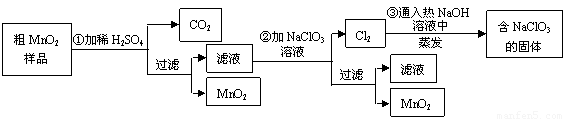
(1)�ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е�________(д��ѧʽ)ת��Ϊ���������ʣ�
(2)�ڢڲ���Ӧ�����ӷ���ʽ�ǣ�________��________ClO3����________��________MnO2����________Cl2����________��
(3)�ڢ۲������������������������̨(����Ȧ)��________��________����������
(4)����MnO2��Ʒ������Ϊ12.69 g���ڢٲ���Ӧ�����˵õ�8.7 g��MnO2�����ռ���0.224 L��CO2(��״����)�����ڵڢٲ���Ӧ��������Ҫ________mol��H2SO4��(��֪Ħ��������MnO2��87 g/mol��MnO��71 g/mol��MnCO3��115 g/mol)

 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�� ����ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
����ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
��֪�ڢ� ����Ӧ�����ӷ���ʽΪ��5Mn2+ + 2ClO3- + 4H2O �� 5MnO2�� + Cl2��
����Ӧ�����ӷ���ʽΪ��5Mn2+ + 2ClO3- + 4H2O �� 5MnO2�� + Cl2�� + 8H+
+ 8H+
����������ɵ�41~46�⣺
41���ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� ��д��ѧʽ��ת��Ϊ������ ���ʡ�
���ʡ�
42��д���ڢ۲���Ӧ�Ļ�ѧ����ʽ  ��
��
43��ʵ��������ɵڢ۲������������������������̨������Ȧ���� �� ����������
44���������п���ѭ��ʹ�õ������� ��
45������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224 L CO2����״���£������ڵڢٲ���Ӧ��������Ҫ mol H2SO4��
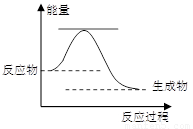
46����֪2H2O2(l) �� 2H2O(l) ��O2(g)����Ӧ���̵������仯��ͼ��ʾ��
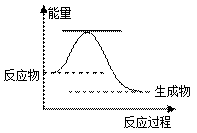 |
�ٸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
������������ͼ�л���ʹ��MnO2������������·�Ӧ��������ϵ�����仯ʾ��ͼ��
 +
+