题目内容
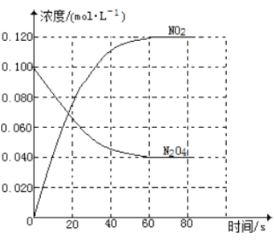
【题目】图1是铜锌原电池示意图。图2中x轴表示实验时流入正极的电子的物质的量,y轴表示( )
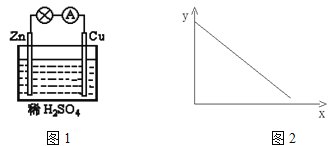
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-)
【答案】C
【解析】
试题分析:铜锌原电池中,Zn是负极,失去电子发生氧化反应,电极反应为Zn-2e-=Zn2+,Cu是正极,氢离子得电子发生还原反应,电极反应为 2H++2e-=H2↑。A.Cu是正极,氢离子得电子发生还原反应,Cu棒的质量不变,故A错误;B.由于Zn是负极,不断发生反应Zn-2e-=Zn2+,所以溶液中c(Zn2+)增大,故B错误;C.由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,故C正确;D.SO42-不参加反应,其浓度不变,故D错误;故选C。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目