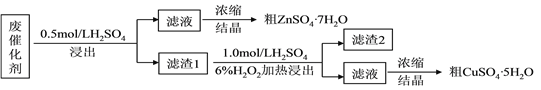题目内容
【题目】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。
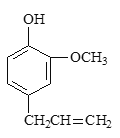
(1)丁子香酚分子式为______________。
(2)下列物质在一定条件下能跟丁子香酚反应的是___________。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
①与NaHCO3溶液反应
②苯环上只有两个取代基
③苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO
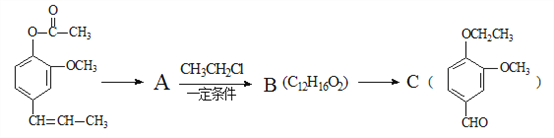
A→B的化学方程式为_______________________,C中滴加少量溴水振荡,主要现象为________________。
【答案】 C10H12O2 a、c、d 5 任写一种 
 溴水褪色
溴水褪色
【解析】(1)由结构简式可知分子式为C10H12O2;
(2)丁子香酚含有碳碳双键、醚键、酚羟基和苯环,具有酚、醚、烯烃和苯的性质,能发生氧化反应、加成反应、还原反应、加聚反应、取代反应等;a.含有酚羟基,所以能与NaOH溶液发生中和反应,故正确;b.不含羧基,所以不能与NaHCO3溶液反应,故错误;c.含有酚羟基,所以能与FeCl3溶液发生显色反应,故正确;d.含有碳碳双键和酚羟基,所以能与Br2发生加成反应、取代反应,故正确;故选acd;
(3)与NaHCO3溶液反应,可分子中应含有-COOH,苯环上的一氯取代物只有两种,说明两个取代基应位于对位位置,则对应的同分异构体有 ;
;
(4)A是丁子香酚的同分异构体,则生成A的反应是水解反应,A的结构简式为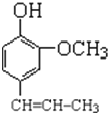 ,A和氯乙烷反应生成B,根据AB分子式知,A发生取代反应生成B,结合题给信息知,B中碳碳双键被氧化生成醛基,则B结构简式为
,A和氯乙烷反应生成B,根据AB分子式知,A发生取代反应生成B,结合题给信息知,B中碳碳双键被氧化生成醛基,则B结构简式为 ,A的结构简式为
,A的结构简式为 、B结构简式为
、B结构简式为 ,A发生取代反应生成B,反应方程式为
,A发生取代反应生成B,反应方程式为 +CH3CH2Cl
+CH3CH2Cl![]()
 +HCl,C含有醛基,加入溴水,发生氧化还原反应,溴水褪色。
+HCl,C含有醛基,加入溴水,发生氧化还原反应,溴水褪色。

 阅读快车系列答案
阅读快车系列答案【题目】研究CO2、CO是处理方法对环境保护用重要意义。
(1)已知:①CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g)![]() CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g)![]() C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=__________。
CH4(g)+2H2O(g) △H=__________。
(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
P后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
①用CO2表示第1小时反应的平均速率v(CO2)=_______mol·L-1·h-1。
②该温度下的H2平衡转化率为______________。
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:
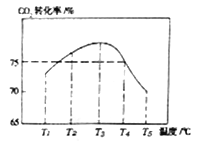
①该反应的△H______0(填“>”或“<”)
②T4℃时该反应的平衡常数K=___________。
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是____________________。
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示
img src="http://thumb.1010pic.com/questionBank/Upload/2018/01/02/09/ce4caee6/SYS201801020935301407189654_ST/SYS201801020935301407189654_ST.003.png" width="212" height="154" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />
①阳极区产生CO2的原因是______________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因_____________。