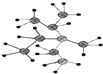
题目内容
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物.
(1)乙醇是无色有特殊香味的液体,密度比水 .
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为 . (不用写反应条件)
(3)下列属于乙醇的同系物的是 , 属于乙醇的同分异构体的是 . (选填编号)
A. 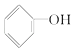 B.
B. 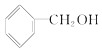 C.CH3 CH2﹣O﹣CH2CH3 D.CH3 OH E.CH3﹣O﹣CH3 F.HO﹣CH2CH2﹣OH
C.CH3 CH2﹣O﹣CH2CH3 D.CH3 OH E.CH3﹣O﹣CH3 F.HO﹣CH2CH2﹣OH
(4)乙醇能够发生氧化反应:
①乙醇在铜作催化剂的条件下可被氧气氧化,反应的化学方程式为 .
②46g乙醇完全燃烧消耗 mol氧气.
③下列说法正确的是(选填字母).
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.实验室制乙烯时,温度控制在140℃
C.黄酒中某些微生物将乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应.
【答案】
(1)小
(2)CH2=CH2+H2O ![]() CH3CH2OH
CH3CH2OH
(3)D;E
(4)2C2H5OH+O2 ![]() 2CH3CHO+2H2O;3;CD
2CH3CHO+2H2O;3;CD
【解析】解:(1.)乙醇的密度比水小,所以答案是:小;
(2.)乙烯中含双键可和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O ![]() CH3CH2OH,
CH3CH2OH,
所以答案是:CH2=CH2+H2O ![]() CH3CH2OH;
CH3CH2OH;
(3.)结构相似,在组成上相差若干个CH2原子团的物质互称同系物,故乙醇的同系物为:甲醇;
分子式相同结构不同的有机物互称同分异构体,故乙醇的同分异构体为甲醚;
所以答案是:D;E;
(4.)①乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O2 ![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O,
所以答案是:2C2H5OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
②46g乙醇的物质的量为: ![]() =1mol,C2H5OH+3O2
=1mol,C2H5OH+3O2 ![]() 2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,
2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,
所以答案是:3;
③A.乙醇含有羟基,能和酸性高锰酸钾溶液发生氧化还原反应,故A错误;
B.实验室制乙烯时,温度控制在170℃,故B错误;
C.黄酒中某些微生物将乙醇氧化为乙酸,乙酸具有酸性,于是酒就变酸了,故C正确
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成乙酸乙酯,乙酸乙酯具有香味,故D正确.
所以答案是:CD.
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案