题目内容
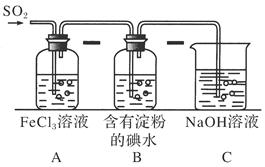
(9分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+的产物是________、________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是____。
(2)下列实验方案适用于在实验室制取所需SO2的是________(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是____________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、________、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是____________________________________。
(6)能表明I-的还原性弱于SO2的现象是____________________________________。
(1)SO42-'Fe2+'1 ∶2 (2)BD (3)吸收SO2尾气,防止污染空气 (4)过滤'BF
(5)方案①'因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色(6)B中蓝色溶液褪色
解析:(1)由2Fe3++SO2+2H2O===2Fe2++4H++SO42-知产物是Fe2+和SO42-,SO2与Fe3+的物质的量比为1∶2。(2)A项HNO3具有强氧化性,将把Na2SO3氧化成Na2SO4,C项,不易控制和收集,故选B、D。(4)要得到FeSO4晶体除蒸发、冷却结晶,自然干燥外还得需要其中过滤操作,因而不需用到仪器石棉网和坩埚。(5)KMnO4具有强氧化性,SO2具有还原性也可发生氧化还原反应而褪色,故方案①不合理。
(6)I2与SO2发生了反应,蓝色溶液褪色。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案