题目内容
【题目】传统的生物脱氮工艺如下图所示,生物脱氮主要包括有氧条件下的硝化反应过程和缺氧环境下的反硝化反应过程。硝化过程中,NH4+先后氧化为NO2和NO2-。
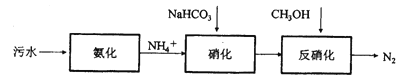
(1) NH4+在硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和。请写出NH4+硝化生成NO2-的离子方程式_________。
(2)①反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的NO2和NO2-还原为N2,如3CH3OH +6NO2-= 3N2↑+3CO2+3H2O+6OH-。新型生物脱氮工艺(SCND)可将硝化过程中的产物控制在NO2阶段,防止生成NO2-,该工艺的优点是_________。
②同步硝化反硝化工艺(SND)将硝化阶段和反硝化阶段放在同一个反应器中进行,该法既有SCND法的优点,将硝化过程中的产物控制在NO2-阶段,还有一个优点是___________。
③现在很多国家采用半硝化工艺(ANAMMOX),工作原理如下图所示:

半硝化脱氮反应器中,一半的NH4+氧化成NO2-,写出厌氧氨氧化发生反应的离子方程式_____。该方法是否需要加入碳源(甲醇),并简述原因________。
(3)研究发现,脱氮工艺会产生-一种温室气体N2O。目前普遍认为在硝化阶段会形成N2O,试分析N2O的成因________。
【答案】 2NH4+ +3O2=2NO2-+2H2O+4H+ 节省进一步氧化所需的耗氧量,同时减少了反硝化反应中加入的碳源(甲醇) 硝化产生的酸和反硝化产生的碱中和,减少了NaHCO3的投加 NH4++NO2- =N2↑+2H2O 不需要,NH4+和NO2-正好反应完全 O2不足,NH4+未被完全氧化为NO2,N元素被氧化为N2O
【解析】(1)在有氧气的条件下,铵根离子被O2氧化成NO2-,反应的离子方程式为:2NH4+ +3O2=2NO2-+2H2O+4H+,故答案为:2NH4+ +3O2=2NO2-+2H2O+4H+
(2)①该工艺将硝化过程中的产物控制在NO2阶段,能减少NO2-的生成,从而减少一步氧化所需的耗氧量,并且能减少碳源(甲醇)的消耗。②将硝化阶段和反硝化阶段放在同一个反应器中进行,能将硝化过程中的产物控制在NO2-阶段,可以使硝化产生的酸和反硝化产生的碱发生中和反应,从而减少NaHCO3的消耗。③在无氧气的条件下,铵根离子与NO2-反应生成N2和H2O,反应的离子方程式:NH4++NO2- =N2↑+2H2O,由于NH4+和NO2-恰好完全发应,所以不需要进一步消耗碳源。答案为:①节省进一步氧化所需的耗氧量,同时减少了反硝化反应中加入的碳源(甲醇)②硝化产生的酸和反硝化产生的碱中和,减少了NaHCO3的投加③NH4++NO2- =N2↑+2H2O、不需要, NH4+和NO2-正好反应完全
(3)当O2不足时,NH4+未被完全氧化为NO2-,N元素由-3价升高到+1价,从而导致N2O的生成。答案为:O2不足,NH4+未被完全氧化为NO2,N元素被氧化为N2O

【题目】观察下列模型并结合有关信息,判断有关说法正确的是( )
B12结构单元 | SF6分子 | S8 | HCN | |
结构模 型示意 图 |
|
|
|
|
备注 | 熔点1873K | — | 易溶于CS2 | — |
A. 单质硼属于原子晶体 B. SF6是由极性键构成的极性分子
C. 固态硫S8属于原子晶体 D. HCN的结构式为HC=N





