题目内容
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。

(1)下列关于氢化钙的叙述正确的是 (选填序号)。
a.氢化钙中阴离子的半径小于Li+的半径
b.氢化钙的式量小于溴化氢,因此前者的熔点小于后者
c.氢化钙也能与盐酸反应生成氢气
d.氢气常用作还原剂,只具有还原性
(2)上图A装置中制备氢气所用的酸溶液最好选用 (选填序号)。
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.均可以
(3)装置D中竖直导管的作用是 。
(4)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是 。加热C装置前要对H2验纯,验纯的操作是 。
(5)甲同学认为只要装置合理、操作规范就可以排除生成 (选填序号)。
a.Ca3N2 b.CaO c.Ca(OH)2
(6)乙同学用下图装置测定制得的氢化钙的纯度。他称取48g样品,与足量的水反应,恒温时,注射器量出产生的气体为48.16 L(已换算为标准状况)。假设钙只与氢气发生了反应,请根据乙同学的实验数据计算氢化钙的纯度(写出计算过程) 。

(1)c
(2)b
(3)平衡压强,防止后面导管堵塞
(4)无水硫酸铜(或其他合理答案);收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音
(5)a、b、c。
(6)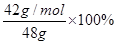 或0.875
或0.875
【解析】
试题分析:(1)a中,氢化钙中H-和Li+的电子构型相同,Li的核电荷数大,半径小,a说法不正确;b项,氢化钙是离子晶体,溴化氢是分子晶体,因此前者的熔点大于后者,不正确;d项,氢气与Ca反应,作氧化剂,d不正确。
(2)制备H2时,使用稀盐酸,气体带HCl气体,也能与Ca反应;使用稀硝酸,气体为氮化物,不会产生H2,所以不行。
(3)洗气瓶中插入液体内部的导管与空气联通,有平衡压强,防止后面导管堵塞(竖直导管意义不大)。
(4)检验水蒸气,一般使用无水硫酸铜(若用水蒸气未除去,则变蓝色);用排水法收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音
(5)开始通入H2,可以排除装置中的空气,没有N2、O2和水蒸气,不会产生Ca3N2、CaO、Ca(OH)2等杂质。
(6)42g·mol-1 n(CaH2)+40 g·mol-1n(Ca)=48
2n(CaH2)+n(Ca)=  解得,n(CaH2)=1mol
解得,n(CaH2)=1mol
则氢化钙的纯度: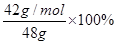 =87.5%或0.875。
=87.5%或0.875。
考点:物质制备实验设计和评价。

|
氢化钙(CaH2中H为-1价)可作为生氢剂,反应的化学方程式为CaH2+2H2O | |
| [ ] | |
A. |
CaH2既是氧化剂又是还原剂 |
B. |
H2既是氧化产物又是还原产物 |
C. |
CaH2是还原剂,H2O是氧化剂 |
D. |
氧化产物和还原产物的质量比是1∶1 |
 Ca(OH)2+2H2↑下列说法错误的是
Ca(OH)2+2H2↑下列说法错误的是