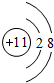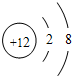题目内容
有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下,可产生2.8 L(标准状况下)H2和0.25 mol ACln;B的气态氢化物的分子式是H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量比为1∶2.88,B核内质子数与中子数相等;C和B可形成CB2液态化合物,并能溶解B的单质,试完成下列问题:
(1)A、B、C的名称;A离子的结构示意图;B在周期表中的位置;CB2的分子式。
(2)用电子式表示A与B形成化合物的过程。
(1)A为钠,B为硫,C为碳 钠离子的结构示意图为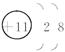 第3周期第ⅥA族 CS2
第3周期第ⅥA族 CS2
(2)![]()
解析:
设A的相对原子质量为x,化合价为n,依题意有
A+nHCl====ACln + ![]() H2↑
H2↑
x g 1 mol 11.2n L
5.75 g 0.25 mol 2.8 L
x=23,n=1,即A为金属钠。
B的氢化物化学式为H2B,设B的相对原子质量为y,则其最高价氧化物对应的水化物化学式为H2BO4。
(y+2)∶(y+66)=1∶2.88,解得y=32,因其核内质子数与中子数相等,质子数=16,故B元素为硫,C与B形成CB2液态化合物,能溶解B的单质,则CB2为CS2,C为碳元素。

练习册系列答案
相关题目