题目内容
下列反应都是用浓盐酸制Cl2,为制得等量Cl2,消耗盐酸最多的是
- A.MnO2+4HCl
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑ - B.KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
- C.KClO3+6HCl→KCl+3Cl2↑+3H2O
- D.4HCl+O2
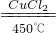 2H2O+2Cl2
2H2O+2Cl2 - E.4HCl+O2
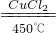 2H2O+2Cl2
2H2O+2Cl2
A
分析:依据化学方程式的定量关系计算进行比较判断,制得等量的氯气,可以假设生成1mol氯气,根据化学方程式计算反应了氯化氢的物质的量,然后对比大小;
解答:A、反应生成1molCl2消耗氯化氢,
MnO2+4HCl MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
4 1
4mol 1mol
故生成1mol氯气时消耗氯化氢4mol;
B、生成1mol1molCl2消耗氯化氢
KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
16 5
3.2mol 1mol
故生成1mol氯气时消耗氯化氢3.2mol;
C、生成1mol1molCl2消耗氯化氢
KClO3+6HCl→KCl+3Cl2↑+3H2O
6 3
2mol 1mol
生成1mol1molCl2消耗氯化氢2mol;
D、生成1mol1molCl2消耗氯化氢
4HCl+O2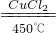 2H2O+2Cl2
2H2O+2Cl2
4 2
2mol 1mol
生成1mol1molCl2消耗氯化氢2mol;
综上所述:A选项的反应消耗盐酸多;
故选A.
点评:本题考查了化学方程式的计算,题目较简单,只要正确应用化学方程式进行计算,就可以比较得到结果.
分析:依据化学方程式的定量关系计算进行比较判断,制得等量的氯气,可以假设生成1mol氯气,根据化学方程式计算反应了氯化氢的物质的量,然后对比大小;
解答:A、反应生成1molCl2消耗氯化氢,
MnO2+4HCl
 MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;4 1
4mol 1mol
故生成1mol氯气时消耗氯化氢4mol;
B、生成1mol1molCl2消耗氯化氢
KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
16 5
3.2mol 1mol
故生成1mol氯气时消耗氯化氢3.2mol;
C、生成1mol1molCl2消耗氯化氢
KClO3+6HCl→KCl+3Cl2↑+3H2O
6 3
2mol 1mol
生成1mol1molCl2消耗氯化氢2mol;
D、生成1mol1molCl2消耗氯化氢
4HCl+O2
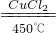 2H2O+2Cl2
2H2O+2Cl24 2
2mol 1mol
生成1mol1molCl2消耗氯化氢2mol;
综上所述:A选项的反应消耗盐酸多;
故选A.
点评:本题考查了化学方程式的计算,题目较简单,只要正确应用化学方程式进行计算,就可以比较得到结果.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑ 2H2O+2Cl2
2H2O+2Cl2 2H2O+2Cl2
2H2O+2Cl2