题目内容
已知A 、B、C、D之间的转化关系如图所示。下列说法正确的是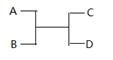
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
D
解析试题分析:A选项,在高温条件下,3Fe+4H2O(g) Fe3O4+4H2,故A错误;B选项,若A、D为化合物,B为水,则C不一定是气体单质,可能是化合物,如:3NO2+H2O=2HNO3+NO,故B错误;C选项,若A、B、C、D均为化合物,该反应一定不一定属于复分解反应,如3NO2+H2O=2HNO3+NO,故C错误;D选项,C是可使湿润的红色石蕊试纸变蓝的气体,则C是氨气,若A、B、C、D均为10电子微粒,且生成氨气,该反应为:NH4++OH-=NH3+H2O,水在常温下呈液态,故D正确;故选D。
Fe3O4+4H2,故A错误;B选项,若A、D为化合物,B为水,则C不一定是气体单质,可能是化合物,如:3NO2+H2O=2HNO3+NO,故B错误;C选项,若A、B、C、D均为化合物,该反应一定不一定属于复分解反应,如3NO2+H2O=2HNO3+NO,故C错误;D选项,C是可使湿润的红色石蕊试纸变蓝的气体,则C是氨气,若A、B、C、D均为10电子微粒,且生成氨气,该反应为:NH4++OH-=NH3+H2O,水在常温下呈液态,故D正确;故选D。
考点:无机物推断

下列由相关实验现象所推出的结论正确的是
| A.C12、SO2均能使滴有酚酞的NaOH溶液褪色,说明二者均有漂白性 |
| B.“水滴石穿”是因为溶解了CO2的雨水与CaCO3作用生成Ca(HCO3)2 |
| C.CuSO4?5H2O遇浓硫酸颜色变白,说明浓硫酸具有脱水性 |
| D.溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
下列示意图与对应的反应情况正确的是: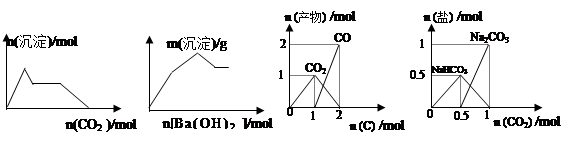
A B C D
| A.含0.01molKOH 和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| C.n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物 |
| D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐 |
如图所示,夹子开始处于关闭状态,将液体A滴人烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体 A和气体B的组合不可能是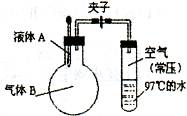
| A.水、氯化氢 |
| B.硫酸、氨气 |
| C.氢氧化钠溶液、二氧化硫 |
| D.氢氧化钠溶液、一氧化碳 |
下列各组物质充分反应后,最终既有沉淀又有气体生成的共有多少组? ( )
①少量Na2O2投入Ca(HCO3)2溶液中
②过量Ba(OH)2溶液和NH4HSO4溶液混合加热
③NaAlO2溶液与NaHCO3溶液混合
④FeCl3溶液与NaHS溶液混合
⑤用铁作阳极长时间电解足量Na2SO4溶液
| A.2组 | B.3组 | C.4组 | D.5组 |
用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊。 | Ca(OH)2溶液 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| | 叙述I | 叙述II |
| A | 水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| B | 往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| D | 利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |