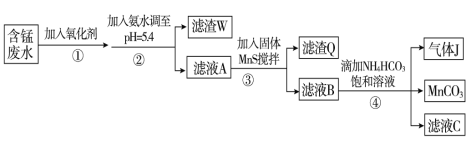
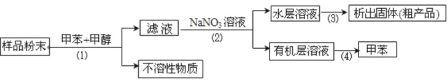
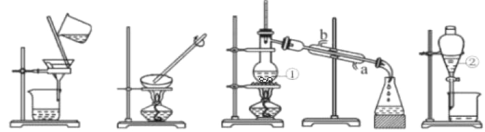
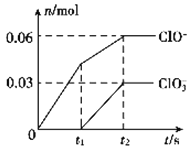
题目内容
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是( )

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
【答案】A
【解析】
试题分析:反应的方程式:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,OH-+H+=H2O,Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,Al(OH)3+OH-=AlO2-+2H2O,沉淀达到最大时,溶液中的溶质是Na2SO4,根据元素守恒,n(H2SO4)=n(Na2SO4)=n(NaOH)/2=40×10-3×10/2mol=0.2mol,c(H2SO4)=0.2/200×10-3mol·L-1=1mol·L-1,故选项A正确。

练习册系列答案
相关题目