题目内容
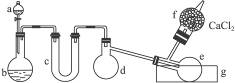
现有N2、NH3、NO2组成的混合气体10L.此混合气体通过稀H2SO4时,溶液增重12.5g,混合气体体积减少到3.28L(体积均在标准状况下测定),则此混合气体中三种成分的体积分别是多少?
此混合气体中N2有1.04升,NH3有2.24升,NO2有6.72升。
据题意,混合气体通过稀H2SO4时的反应为:2NH3+H2SO4=(NH4)2SO4?
混合气中的NH3留在溶液中,增加了质量,并使混合气的体积缩小.同时3NO2+H2O=2HNO3+NO也使溶液增加了质量和气体体积缩小了,生成的NO气的体积是混合气中NO2体积的1/3.通过稀硫酸后的气体是原混合气中的N2和新生成的NO气的混合气体。
稀硫酸溶液质量的增加量是原混合气中NH3的量和NO2跟水反应与生成NO的质量差。
设:原混合气中的NO2为xL,NH3为yL,则N2为(10-x-y)L。
根据题意,可到方程组:
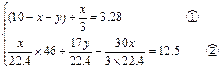
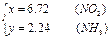

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目