题目内容
下列判断错误的是( )
分析:A、金属性越强,则对应的最高价氧化物的水化物的碱性越强;
B、熔点的一般规律:原子晶体>离子晶体>分子晶体;
C、非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、结构相似的分子晶体相对分子质量越大,熔点越高,含有氢键的熔点高.
B、熔点的一般规律:原子晶体>离子晶体>分子晶体;
C、非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、结构相似的分子晶体相对分子质量越大,熔点越高,含有氢键的熔点高.
解答:解:A、同周期从左到右金属性减弱,所以金属性:Na>Mg>Al,则对应的最高价氧化物的水化物的碱性:NaOH>Mg(OH)2>Al(OH)3,故A正确;
B、熔点的一般规律:原子晶体>离子晶体>分子晶体,Si3N4为原子晶体,NaCl为离子晶体,SiI4为分子晶体,所以熔点:Si3N4>NaCl>SiI4,故B正确;
C、同周期从左到右非金属性逐渐增强,所以非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故C正确;
D、结构相似的分子晶体相对分子质量越大,熔点越高,含有氢键的熔点高,NH3中含有氢键,所以沸点:NH3>AsH3>PH3,故D错误.
故选D.
B、熔点的一般规律:原子晶体>离子晶体>分子晶体,Si3N4为原子晶体,NaCl为离子晶体,SiI4为分子晶体,所以熔点:Si3N4>NaCl>SiI4,故B正确;
C、同周期从左到右非金属性逐渐增强,所以非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故C正确;
D、结构相似的分子晶体相对分子质量越大,熔点越高,含有氢键的熔点高,NH3中含有氢键,所以沸点:NH3>AsH3>PH3,故D错误.
故选D.
点评:本题考查了金属性和非金属性的比较及元素周期律,物质熔点的比较等,熟悉金属性和非金属元素的性质变化规律及非金属性的比较方法即可解答,难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列判断错误的是( )
| A、沸点:HF>HI>HCl | B、酸性:HClO4>H2CO3>HClO | C、微粒半径:O2->Al3+>Na+ | D、碱性:KOH>Ca(OH)2>Mg(OH)2 |
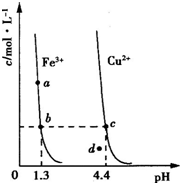 (2010?山东)某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
(2010?山东)某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )