题目内容
下图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属M沉淀出来:电极反应为______,同时电极C产生______,电极反应为______,电极D产生______,电极反应为______。
(1)电池中P是______极,Q是______极。
(2)A极上电极反应为______。
(3)当电路中通过2.408×1022个电子时,B极上沉淀出1.27gM,则M的计算式为______。
(4)如果将电池的正负极交换,接入原电路通过1.204×1022个电子时,看到B极上______.电极反应为______,A极上析出______ g ______,电极反应为______(假设M为Cu)。

解析:
M2++2e-=M;氧气;4OH--4e‑-=2H2O+O2↑;氢气;2H++2e--=H2↑; (1)正极;负极; (2)M-2e-=M2+ ; (3) (4)放出氧气,4OH--4e-=2H2O+O2↑;A极析出0.63g,铜;Cu2+-2e-=Cu <
|
提示:
根据题中已知(甲)电解池的B极上有金属M析出,可知在B极上发生了还原反应:M2++2e=M,由M2+阳离子在B极上获得电子而还原,可判断B极是阴极,与B极相连的C极一定是阳极。所以在(乙)电解池中,阴离子在C极放电:4OH--4e-=2H2O+O2↑所以在C极上有氧气放出。D极是阴极,溶液中的阳离子将在该极放电:2H++2e-=H2↑所以D极上有氢气放出。 通过上述的分析和判断,很容易推知A为阳极。而与A连接的电池P极一定是正极,Q为负极。这时可以看到A极溶解,发生了下述反应:M-2e-=M2+,当电路中通过2.408×1022个电子时,M2+离子将在B极上放电并析出,其质量是1.27g。计算M的相对原子质量: M2+ + 2e- = M 2e- x
x= M元素为铜元素 如果将电池的正负极交换,接入原电路,通过1.204×1022个电子时,因为这时B极是阳极,所以溶液中的阴离子将向阳极移动,并在阳极放电:4OH--4e=2H2O+O2↑ ,B极上有氧气放出。如果M是铜,则在A极上将有铜析出,即M2++2e-=M或Cu2++2e-=Cu。 根据题中的已知条件列算式: Cu2+ + 2e- = Cu 2e- 63.5 x=
|

碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)

A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。
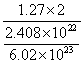 ;
;
 =0.635g
=0.635g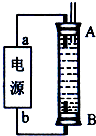 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: