题目内容
已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.某兴趣小组用乙醛与新制的氢氧化铜共热会生成Cu2O红色沉淀,有同学对此提出质疑,认为红色沉淀还可能为Cu2O和Cu的混合物,为了验证上述猜测,他们设计如下方案:
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |
(2)上述三个方案中,你认为最合理的是 ,实施该实验方案能说明红色沉淀仅是Cu2O的依据是 ;
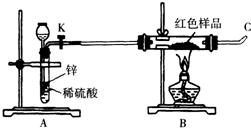
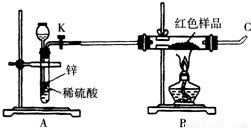
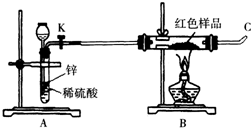
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测.
进行该实验时,称量装有红色样品的双通管并连接各仪器之后,开通阀门K后,应进行的实验操作是 ,在C处点燃或接贮气囊,再点燃B处酒精灯.
【答案】分析:(1)硝酸具有强氧化性,将Cu2O和Cu氧化.
(2)方案甲,氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,即使只有Cu2O,也有不溶物,故不合理.
方案乙,硝酸具有强氧化性,将Cu2O氧化物为硝酸铜,溶液呈蓝色,不能说明是否含有Cu,故不合理.
方案丙,根据固体的增重判断其成分,比较合理.若只有Cu2O,根据方程式可a与b的关系.
(3)通入氢气排除装置空气,并置换出铜.氢气为易燃气体,加热前,应检验C处出来的氢气纯度.
解答:解:(1)硝酸具有强氧化性,将Cu2O和Cu氧化.反应方程式为3Cu2O+14HNO3=6Cu(NO3)2+7H2O+2NO↑;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+7H2O+2NO↑;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(2)方案甲,氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,即使只有Cu2O,也有不溶物,故不合理.
方案乙,硝酸具有强氧化性,将Cu2O氧化物为硝酸铜,溶液呈蓝色,不能说明是否含有Cu,故不合理.
方案丙,根据固体的增重判断其成分,方案合理.
若只有Cu2O,根据方程式2Cu2O+O2=4CuO
288 320
ag bg
所以 a:b=288:320=9:10
故答案为:丙;a:b=9:10
(3)氢气为易燃气体,加热前,应检验C处出来的氢气纯度.
故答案为:应检验C处出来的氢气纯度.
点评:以铜的化合物的性质信息为载体,考查学生实验对实验原理、实验装置的理解、对实验方案评价,综合性大,难度中等.关键是理解实验原理.
(2)方案甲,氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,即使只有Cu2O,也有不溶物,故不合理.
方案乙,硝酸具有强氧化性,将Cu2O氧化物为硝酸铜,溶液呈蓝色,不能说明是否含有Cu,故不合理.
方案丙,根据固体的增重判断其成分,比较合理.若只有Cu2O,根据方程式可a与b的关系.
(3)通入氢气排除装置空气,并置换出铜.氢气为易燃气体,加热前,应检验C处出来的氢气纯度.
解答:解:(1)硝酸具有强氧化性,将Cu2O和Cu氧化.反应方程式为3Cu2O+14HNO3=6Cu(NO3)2+7H2O+2NO↑;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+7H2O+2NO↑;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(2)方案甲,氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,即使只有Cu2O,也有不溶物,故不合理.
方案乙,硝酸具有强氧化性,将Cu2O氧化物为硝酸铜,溶液呈蓝色,不能说明是否含有Cu,故不合理.
方案丙,根据固体的增重判断其成分,方案合理.
若只有Cu2O,根据方程式2Cu2O+O2=4CuO
288 320
ag bg
所以 a:b=288:320=9:10
故答案为:丙;a:b=9:10
(3)氢气为易燃气体,加热前,应检验C处出来的氢气纯度.
故答案为:应检验C处出来的氢气纯度.
点评:以铜的化合物的性质信息为载体,考查学生实验对实验原理、实验装置的理解、对实验方案评价,综合性大,难度中等.关键是理解实验原理.

练习册系列答案
相关题目
 已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.
已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.
某兴趣小组用乙醛与新制的氢氧化铜共热会生成Cu2O红色沉淀,有同学对此提出质疑,认为红色沉淀还可能为Cu2O和Cu的混合物,为了验证上述猜测,他们设计如下方案:
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |
(2)上述三个方案中,你认为最合理的是______,实施该实验方案能说明红色沉淀仅是Cu2O的依据是______;
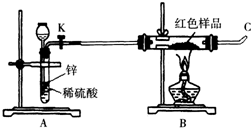
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测.
进行该实验时,称量装有红色样品的双通管并连接各仪器之后,开通阀门K后,应进行的实验操作是______,在C处点燃或接贮气囊,再点燃B处酒精灯.
已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.
某兴趣小组用乙醛与新制的氢氧化铜共热会生成Cu2O红色沉淀,有同学对此提出质疑,认为红色沉淀还可能为Cu2O和Cu的混合物,为了验证上述猜测,他们设计如下方案:
(1)如果红色沉淀是Cu2O和Cu的混合物,按上述方案乙进行实验,写出可能发生反应的化学方程式 ;
(2)上述三个方案中,你认为最合理的是 ,实施该实验方案能说明红色沉淀仅是Cu2O的依据是 ;
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测.
进行该实验时,称量装有红色样品的双通管并连接各仪器之后,开通阀门K后,应进行的实验操作是 ,在C处点燃或接贮气囊,再点燃B处酒精灯.
某兴趣小组用乙醛与新制的氢氧化铜共热会生成Cu2O红色沉淀,有同学对此提出质疑,认为红色沉淀还可能为Cu2O和Cu的混合物,为了验证上述猜测,他们设计如下方案:
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |
(2)上述三个方案中,你认为最合理的是 ,实施该实验方案能说明红色沉淀仅是Cu2O的依据是 ;
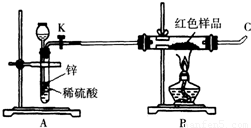
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测.
进行该实验时,称量装有红色样品的双通管并连接各仪器之后,开通阀门K后,应进行的实验操作是 ,在C处点燃或接贮气囊,再点燃B处酒精灯.

 (2011?惠州模拟)已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.
(2011?惠州模拟)已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.